У що може «вилитися» реалізація нелегальних ветеринарних препаратів?
Скрипник В.Г., доктор ветеринарних наук, генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок.
На вихідних допомагав давньому знайомому проводити ревізію ветеринарних препаратів у його аптеці. Знаю його як освічену, прогресивну людину з вищою ветеринарною освітою. А передували цьому дійству наші розмови про обіг препаратів і кількість нелегальних препаратів на ринку України.
Під час ревізії з’ясувалося, що він ніколи не звертав увагу і ніколи не перевіряв препарати на предмет їх реєстрації в Україні. Йому було достатньо інформації на етикетці та супровідних документів до препарату. Асортимент формували згідно попиту, консультацій з колегами по напрямку діяльності та враховуючи власний досвід і свою інтуїцію.
В результаті проведеної ревізії ми встановили, що асортимент препаратів містить 63% нелегальних препаратів. Серед них 16% – препарати контрабандні, переважно з Російської Федерації.
Далі у нас була розмова про бізнес, етичність, моральність, аморальність у веденні бізнесу і т.п. Головний аргумент товариша: « Так працюють усі. Є попит – даємо пропозицію» мене особисто не задовольняє. Тому змушений був заглибитися в нормативну базу. Ось що ми будемо мати рівно через 13 місяців.
У Законі України «Про ветеринарну медицину», який вступає в силу 21 березня 2023 року сказано:
- Внести зміни до таких законодавчих актів України:
- у Кодексі України про адміністративні правопорушення (Відомості Верховної Ради УРСР, 1984 р., додаток до № 51, ст. 1122):
Стаття 107. Порушення законодавства про ветеринарну медицину та благополуччя тварин:
« Порушення вимог законодавства щодо виробництва, обігу та застосування ветеринарних препаратів, провадження ветеринарної практики, переміщення (обігу) тварин, побічних продуктів тваринного походження, репродуктивного матеріалу та біологічних продуктів, захисту здоров’я та карантину тварин, а також рішень державних надзвичайних протиепізоотичних комісій –
тягне за собою накладення штрафу на громадян від п’ятдесяти до ста неоподатковуваних мінімумів доходів громадян і на посадових осіб – від вісімдесяти до ста двадцяти неоподатковуваних мінімумів доходів громадян.
Повторне протягом року вчинення порушення, передбаченого частиною третьою цієї статті, за яке особу вже було піддано адміністративному стягненню, –
тягне за собою накладення штрафу на громадян від ста до ста п’ятдесяти неоподатковуваних мінімумів доходів громадян і на посадових осіб – від ста двадцяти до ста вісімдесяти неоподатковуваних мінімумів доходів громадян”;
« Від імені центрального органу виконавчої влади, що реалізує державну політику у сфері безпечності та окремих показників якості харчових продуктів та у сфері ветеринарної медицини, розглядають справи про адміністративні правопорушення і накладають адміністративні стягнення:
Головний державний інспектор України, Головний державний ветеринарний інспектор України та їх заступники, головні державні інспектори, головні державні ветеринарні інспектори та їх заступники, державні інспектори та державні ветеринарні інспектори центрального органу виконавчої влади, що реалізує державну політику у сфері безпечності та окремих показників якості харчових продуктів та у сфері ветеринарної медицини, – штраф до ста вісімдесяти неоподатковуваних мінімумів доходів громадян».
Оскільки всі реалізатори препаратів люди освічені і мій товариш також, то вони знають (або вважають, що знають), що неоподатковуваний мінімум доходів громадян — грошова сума розміром у 17 гривень. А тому вважають, що штраф = 17 грн х100 (в середньому)= 1700 грн, такий собі. Можна і ризикнути.
Насправді треба читати до кінця:
«Неоподатковуваний мінімум доходів громадян — грошова сума розміром у 17 гривень, встановлена пунктом 5 підрозділу 1 розділу XX Податкового кодексу України, яка застосовується при посиланнях на неоподаткований мінімум доходів громадян в законах або інших нормативно-правових актах, за винятком норм адміністративного та кримінального законодавства у частині кваліфікації злочинів або правопорушень, для яких сума неоподатковуваного мінімуму встановлюється на рівні податкової соціальної пільги, визначеної підпунктом 169.1.1 пункту 169.1 статті 169 розділу IV ПКУ для відповідного року.
Підпунктом 169.1.1 статті 169 визначено, що податкова соціальна пільга дорівнює 50 відсоткам розміру прожиткового мінімуму для працездатної особи (у розрахунку на місяць), встановленому законом на 1 січня звітного податкового року, — для будь-якого платника податку».
Наприклад, з 1 січня 2022 року прожитковий мінімум для працездатної особи з розрахунку на місяць складиме 2481 грн. Отже в 2022 році для норм адміністративного та кримінального законодавства у частині кваліфікації адміністративних або кримінальних правопорушень застосовується неоподатковуваний мінімум в розмірі 1240,50 грн. На 1 січня 2023 року прожитковий мінімум, наприклад, стане 3000 грн. Отже в 2023 році буде застосовуватися неоподатковуваний мінімум в розмірі 1500 грн.
А це значить, що середній штраф буде 1500х100=150 000 грн, а головні державні інспектори та головні державні ветеринарні інспектори мають право виписати 180 таких мінімумів. А це уже буде 180х1500=270 000 грн.
І це вже суттєво. Чи вартує реалізація нелегальних препаратів для більшості реалізаторів таких ризиків? Напевне що ні. То може потрібно вже зараз подумати про заміну нелегального асортименту на легальний? Адже за день, тиждень, а може й за місяць вивести нелегальний асортимент без економічних втрат не вийде.
Думайте.
Сіра зона 3.
Валерій Скрипник, генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок.
Продовжуємо інформувати ветеринарну спільноту та суспільство в цілому щодо обігу ветеринарних препаратів у тіньовому сегменті ринку. Для ваших подальших роздумів, а можливо швидких дій, надаємо інформацію, надану Державним науково-дослідним контрольним інститутом ветеринарних препаратів і кормових добавок за 2019 рік.
Ми розуміємо, що інформація може бути не актуальною по якихось конкретних позиціях, а кілька десятків препаратів пройшли процедуру державної реєстрації і кінцева таблиця ДНДКІ ВП і КД скорегована. Мета наших публікацій – привернути увагу фахівців ветеринарної медицини і суспільства в цілому до проблеми, яка наразі починає становити реальну загрозу здоров’ю тварин і людей, навколишньому середовищу, економічній і біологічній безпеці держави. Наведені дані не охоплюють всі аспекти ринку ветпрепаратів. Але в цілому тут можна побачити постійних виробників і продавців продукції невідомої якості, видно глибину та масштаби явища тіньового обігу, певних учасників цього процесу.
Тож колеги думайте, вибирайте. Чи варто ризикувати здоров’ям тварин і людей задля сумнівної економічної вигоди? Від ваших дій залежить не так і мало. Може настав час відмовлятися від сірих препаратів?
Сіра зона 2.
Валерій Скрипник, генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок.
Наша публікація «Сіра зона» , яка мала на меті привернути увагу фахівців до виникнення глобальних ризиків, натомість викликала низку більш прикладних зауважень, підтримки і обурення, пропозицій і погроз з боку людей, причетних до ветеринарного бізнесу. В більшості своїй це були емоційні а не конструктивні виступи. Але й це дуже добре. Можливо вдасться привернути суспільну думку до важливих для життя тварин, людей і держави в цілому речей. Давайте розпочнемо із самих себе, з т.з. “низів”. У Держави завжди є набагато важливіші нагальні питання для існування та виклики сьогодення. Тому їй поки не до здоров’я тварин (у глобальному сенсі).
Не хочу повторюватися і цитувати наші попередні публікації, а тому перед викладенням інформації лише маленька преамбула.
- Більшість бізнесів (у будь-якій країні) не є пухнастими і білими на 100%. І всі причетні до цього це знають, а більшість споживачів про це здогадується.
- Більшість керівників такого бізнесу не є пухнастими і білими на 100%.
- Враховуючи вищевказані пункти не лінуйтеся перевіряти препарати, які закуповуєте, на їх легітимність. Так, зараз це не просто. Державні реєстри зареєстрованих ветпрепаратів складні для швидкого використання, але при планових закупівлях це можна робити.
- Спробуйте відмовитися від «сірих» препаратів. Лікарі – при застосуванні, дистрибутори – при закупівлі та реалізації. Сенсу виготовляти такий асортимент у виробника не буде взагалі.
Звертаємо вашу увагу на те, що згідно Законопроекту 3318, який пройшов перше читання у ВРУ, передбачено: у Кодексі України про адміністративні правопорушення (Відомості Верховної Ради УРСР, 1984 р., додаток до № 51, ст. 1122):
б) статтю 107 викласти в такій редакції:
“Стаття 107. Порушення законодавства про ветеринарну медицину та благополуччя тварин
Порушення вимог законодавства щодо виробництва, обігу та застосування протимікробних ветеринарних лікарських засобів –
тягне за собою накладення штрафу на громадян від ста до двохсот неоподатковуваних мінімумів доходів громадян, а на спеціалістів ветеринарної медицини – від двохсот до чотирьохсот неоподатковуваних мінімумів доходів громадян;
Порушення інших вимог законодавства щодо виробництва, обігу та застосування ветеринарних препаратів –
тягне за собою накладення штрафу на громадян від шістдесяти до ста п’ятдесяти неоподатковуваних мінімумів доходів громадян, а на спеціалістів ветеринарної медицини – від ста до двохсот неоподатковуваних мінімумів доходів громадян.
Далі, доповнення до іншого Закону України, зокрема передбачає:
17) пропонування до реалізації або реалізація незареєстрованих ветеринарних препаратів, якщо обов’язковість їх державної реєстрації встановлена законом, –
тягне за собою накладення штрафу на юридичних осіб у розмірі тридцяти мінімальних заробітних плат, на фізичних осіб – підприємців – у розмірі вісімнадцяти мінімальних заробітних плат;
18) невиконання вимог до безпечності, якості та ефективності ветеринарного препарату, встановлених під час його державної реєстрації –
тягне за собою накладення штрафу на юридичних осіб у розмірі двадцяти п’яти мінімальних заробітних плат, на фізичних осіб – підприємців – у розмірі дванадцяти мінімальних заробітних плат;
19) надання недостовірної інформації під час державної реєстрації ветеринарного препарату, якщо це створює загрозу для життя та/або здоров’я людини та/або тварини –
тягне за собою накладення штрафу на юридичних осіб у розмірі п’ятдесяти мінімальних заробітних плат, на фізичних осіб – підприємців – у розмірі тридцяти мінімальних заробітних плат;
20) порушення вимог законодавства щодо ведення записів про побічні реакції на ветеринарні препарати, реєстрації таких побічних реакцій та повідомлення про них компетентного органу –
тягне за собою накладення штрафу на юридичних осіб у розмірі дванадцяти мінімальних заробітних плат, на фізичних осіб – підприємців – у розмірі восьми мінімальних заробітних плат;
Тож колеги, думайте. Від ваших дій залежить не так і мало. Може настав час готуватися до життя в умовах нового законодавства та відмовлятися від сірих препаратів?
Для ваших подальших роздумів, а можливо швидких дій, надаю інформацію, надану Державним науково-дослідним контрольним інститутом ветеринарних препаратів і кормових добавок:
«…Інформуємо Вас, що впродовж 2019 року, за результатами моніторингу продукції в інтернет-аптеках України, виявлено 401 найменування незареєстрованих ветеринарних препаратів, із яких 248 (61,9%) – вітчизняних і 153 (38,2%) – зарубіжного виробництва.
Результати аналізу ринку України у першому кварталі 2020 року вказують на реалізацію інтернет-аптеками 106 найменувань незареєстрованої продукції, з яких 67 (71,0%) – вітчизняного і 39 (29,0%) – зарубіжного виробництва».
Ми розуміємо, що інформація може бути не актуальною по якихось конкретних позиціях. Метою наших публікацій є привернути увагу фахівців ветеринарної медицини і суспільства в цілому до проблеми, яка наразі починає становити реальну загрозу здоров’ю тварин і людей, навколишньому середовищу, економічній і біологічній безпеці держави. Наведені дані не охоплюють всі аспекти ринку ветпрепаратів. Але в цілому тут, як на розрізі, видно і глибину та масштаби явища тіньового обігу, основні тенденції та певних учасників цього процесу.
Однобока боротьба з антибіотикорезистентністю в Україні
Скрипник В.Г., доктор ветеринарних наук, генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок.
В останні роки весь світ переймається надзвичайно важливою для здоров’я людей проблемою – стійкістю мікроорганізмів до антибактеріальних лікарських засобів, у тому числі ветеринарних. Україна також докладає зусиль для зменшення негативного впливу стійких до антимікробних препаратів мікроорганізмів. Так, Кабінет Міністрів України затвердив Національний План дій боротьби зі стійкістю до протимікробних препаратів, МОЗ України продовжує впроваджувати принцип “Єдине здоров’я”, що передбачає, окрім контролю використання антибіотиків у медицині, контроль обігу антибіотиків у ветеринарії. Окрім того, для комплексної боротьби з проблемою та забезпечення раціонального використання антибіотиків у медицині, ветеринарній медицині та харчовій промисловості, запропоновано розробити чіткі інструкції медикам і ветеринарам (уже розробляється), які повинні мінімізувати ризики невиправданого використання протимікробних препаратів. Проводиться певна просвітницька робота, організовуються круглі столи по обговоренню проблеми, семінари, конференції, виконуються програми моніторингу за контролем резистентності до протимікробних препаратів.
Проектом Закону України № 3318 «Про ветеринарну медицину та благополуччя тварин» також передбачено певні обмеження щодо безконтрольного застосування протимікробних препаратів і впроваджуються норми для обгрунтованого, раціонального застосування таких препаратів.
В той же час, всі ці корисні дії і заходи виглядають смішно і навіть жалюгідно на фоні величезного, неконтрольованого тіньового ринку обігу ветеринарних препаратів. Є чимало виробників і дистрибуторів, яких прийнято відносити до так званої «сірої» або тіньової зони господарювання. Їх кількість і виробничі потужності достеменно невідомі. Вони і є розповсюджувачами ветеринарних препаратів сумнівної якості. За даними Державного науково-дослідного контрольного інституту ветпрепаратів і кормових добавок та нашими спостереженнями зараз на ринку ветпрепаратів України знаходиться величезна кількість препаратів, які можна об’єднати під однією назвою – «препарати сумнівної якості». Це препарати вітчизняного походження, але не зареєстровані в Україні, фальсифіковані та контрабандні.
В окремих випадках обсяги продукції сумнівної якості сягають до 70% і навіть 100% переліку продукції компаній. Такі препарати завдають шкоди здоров’ю тварин і людей, економічних і іміджевих збитків держави в цілому. Дослідження лише мережі інтернет-аптек ринку ветеринарних препаратів, проведені ДНДКІ ветеринарних препаратів і кормових добавок у 2019 році, виявили більше ніж 400 найменувань не зареєстрованих препаратів із яких 60 % вітчизняного виробництва і 40% закордонного (тобто контрабандних). Контрабандні препарати мають широку географію походження – з Європи, Північної і Південної Америки, Азії та Африки. 50 відсотків із них завозяться із РФ. Враховуючи обмеженість проведеної роботи можна спрогнозувати, що ця незаконна діяльність перевершує за обсягами діяльність легальну. Тіньовий обіг фальсифікованих і контрабандних ветеринарних препаратів і кормів для тварин сягає сотень мільйонів гривень. Детальніше інформацію можна подивитися на сайті інституту за посиланням www.scivp.lviv.ua.
У світі немає аналогу українському «ноу-хау» – застосуванню для лікування тварин активно діючої речовини (субстанція, АФІ) без використання лікарської форми. У нас досить часто 100% чистий антибіотик використовують для лікування і профілактики хвороб тварин і птиці у промислових масштабах. Тобто, якщо для досягнення терапевтичного ефекту необхідно 5 – 20% діючої речовини, то використання чистої діючої речовини – у 10-20 разів діє сильніше, ніж це необхідно для досягнення терапевтичного ефекту. Це негативно впливає на якість тваринницької продукції, а найголовніше – на здоров’я людей та навколишнє середовище і екологічну безпеку країни. Застосування таких методів лікування тварин призводить до селекції надзвичайно стійких до лікарських засобів штамів мікроорганізмів. Це несе в собі велику загрозу здоров’ю людей. Бо викликавши захворювання у людини такий мікроорганізм не знешкоджується препаратами вибору, хвороба не лікується, а за час, що потрібен для встановлення діагнозу, виділення мікроорганізму та визначення його чутливості до антибактеріальних препаратів можливі тяжкі ускладнення перебігу та летальні випадки.
Висновки. Дані наукової літератури свідчать, що з 115 основних антибіотиків патогенні мікроорганізми слабко чутливі або не чутливі взагалі до 68. В той же час встановлено, що метод обмеження використання антибактеріальних препаратів є неефективним. Експерти визначають два виходи з даної ситуації: інтенсифікувати розробку та впровадження нових антимікробних препаратів або знаходити методи контролю розповсюдження резистентності мікроорганізмів до препаратів, що вже існують і використовуються.
Наразі більшість основних виробників препаратів обмежили інвестування у дослідження антибіотиків. Причиною цього стало низьке відшкодування витрат на розробку препаратів. Нові ветеринарні лікарські засоби слід застосовувати мінімально, щоб уповільнити неминучу еволюцію резистентності до них. Це означає, що компанії не можуть розраховувати на великі продажі нових препаратів, а тому будуть відмовлятися від їх розробки. Без нових антибіотиків і зі збільшенням резистентності мікроорганізмів хвороби, які раніше вважали легкими, стануть невиліковними.
Політика нашої держави у галузі ветеринарної фармації виглядає не дуже розумною. Діючими нормативними документами створено не обгрунтовані перешкоди для розробки та виробництва якісних і ефективних генеричних препаратів, доступних для широкого споживача. Жорсткі нормативні вимоги пропонуються до впровадження у новому законопроекті 3318. В той же час, жорсткі нормативні вимоги для легальних виробників і відсутність державного контролю за обігом ветеринарних препаратів на ринку, призводять до втрати конкурентоспроможності якісних препаратів від легальних виробників перед «тіньовими» препаратами невідомої якості. Це, в свою чергу, призводить до ще більшого розвитку «тіньового» ринку та зменшення обсягів виробництва якісних препаратів легальними компаніями.
Без викорінення тіньового ринку обігу ветеринарних препаратів, всі дії, спрямовані на просвітницьку діяльність, унормування процедур використання антибактеріальних препаратів, моніторингу резистентності мікроорганізмів та залишків препаратів у продуктах споживання людиною, не мають великого значення та лише вводять в оману суспільство і керівництво держави, створюючи ілюзію активної діяльності. Без комплексного підходу вирішувати проблеми резистентності мікроорганізмів та забезпечення здоров’я нації неможливо.
Що ховається за звичайними законодавчими визначеннями (ч.2).
Скрипник В.Г., доктор ветеринарних наук, генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок (Ветпромспілка).
В частині першій даної публікації ми писали, що текст нової редакції Закону України «Про ветеринарну медицину» розглядається робочою групою при ВР України. Наразі статус документу не змінився. Текст доопрацьовується. Відомо, що доопрацювання проводять розробники (група юристів під керівництвом Тоні Віла). Тому ми продовжимо розглядати останню версію оприлюдненого документу від 11.09.19.
Розглянемо ще одне визначення на яке хочемо звернути увагу розробників і виробників ветеринарних препаратів:
119) референтний ветеринарний лікарський засіб (ветеринарний препарат) – ветеринарний лікарський засіб (ветеринарний препарат), зареєстрований в Україні згідно повного реєстраційного досьє з доведеними ефективністю, безпечністю та якістю і з яким порівнюється досліджуваний ветеринарний лікарський засіб (ветеринарний препарат).
На нашу думку суттєва національна вимога, яка не застосовується у ЄС та гуманній медицині України («зареєстрований в Україні згідно повного реєстраційного досьє»), що внесена контролюючою організацією, несе в собі низку ризиків для виробників та компетентного органу.
- Визначення «референтного ВЛЗ» не відповідає Регламенту ЄС 2019/6 (п.8 ст.4) і має бути змінене;
– Очікування реєстрації інноваційного препарату за «повним досьє» в Україні (якщо така реєстрація відбудеться взагалі) затримує розробку вітчизняного генерика на 15-20 років після виходу оригінального препарату, що призводить до втрати актуальності генерика і можливості застосовувати необхідні препарати споживачами за доступною ціною;– Відсутнє визначення «повного досьє», та відсутня інформація у виробників щодо препаратів, які зареєстровані за «повним досьє»;– Визначений компетентним органом України препарат, зареєстрований за «повним досьє» не обов’язково повинен бути референтним препаратом для інших країн;– Якщо референтним препаратом визначено препарат, який не є референтним препаратом в інших країнах, то проведені дослідження з біоеквівалентності або порівняльні клінічні дослідження не будуть вважатися там доказовими щодо ефективності, безпечності та нешкідливості при реєстрації. Тому низку тривалих і вартісних досліджень виробники змушені будуть повторювати з іншим референтним препаратом, втрачаючи час і великі кошти на проведення нових досліджень.– Препарат, зареєстрований за «повним досьє», може втратити статус референтного при реєстрації в Україні ветеринарного препарату з більш повним щодо доказовості реєстраційним досьє. У такому випадку раніше проведені дослідження вважаються неактуальними.
В даний час і розробники препаратів і контролюючі органи користуються положеннями пункту 2 ст.64 ЗУ «Про ветеринарну медицину», де референтний препарат визначено як «патентований препарат (препарат-бренд), зареєстрований в Україні та в інших країнах…». Дане визначення більше 10 років використовується в Україні та задовольняло і розробників і контролюючі органи. Крім того, гуманна фармація також відійшла від прив’язки визначення «референтний препарат» до обов’язкової реєстрації оригінального препарату в Україні. Тому ми пропонуємо таке визначення:
«119) референтний ветеринарний лікарський засіб (ветеринарний препарат) – ветеринарний лікарський засіб (ветеринарний препарат), з яким порівнюється досліджуваний лікарський засіб і який є, насамперед, оригінальним (інноваційним) лікарським засобом з доведеними ефективністю, безпечністю та якістю» ( Наказ МОЗ №460 від 23.07.2015).
Ми вважаємо, що дане формулювання є більш прийнятним для розробників і виробників і цілком адекватним для контролю якості препарату.
Хочемо звернути увагу розробників і виробників препаратів на ще одне характерне положення. Стаття 56 пункт 7:
«7. З метою державної реєстрації вітчизняного імунобіологічного ветеринарного лікарського засобу заявник включає до реєстраційного досьє документи (відомості) про наявні у розпорядженні виробника головні посівні культури штамів мікроорганізмів, які використовуються під час виробництва та контролю такого ветеринарного імунологічного лікарського засобу та умови для їх підтримання і зберігання. Ідентичність та мікробіологічна чистота культур мікроорганізмів мають бути підтверджені Національним центром штамів мікроорганізмів».
Вражає цинізм і нахабність, з якими просувається ця норма в законопроект. При цьому продовжує дивувати синергія розробників законопроекту, які розповідають про виваженість, адекватність, паритет, європейські цінності і т.п., та вітчизняних державних контролерів. Зверніть увагу, як ці групи людей згуртовано діють саме проти вітчизняного виробництва. З приводу цього пункту законопроекту неодноразово точилися дискусії, але віз і нині там. Оскільки європейські виробники сказали однозначно, що жодна компанія не надасть до Національного центру штамів мікроорганізмів виробничі штами мікроорганізмів (їх завуалювали під виглядом «головних посівних культур штамів мікроорганізмів». До речі, такого визначення не існує), то «призначили крайніми» вітчизняних виробників.
Пояснюємо цей меседж. Виробничі штами мікроорганізмів є власністю компанії-виробника. Ця власність є унікальною за своїми властивостями. Її можна порівняти з унікальною формулою нової хімічної речовини (наприклад нового антибіотика). А тому, передаючи цю унікальну річ до третіх осіб (як би вони себе не називали) компанія ризикує втратити свою власність. В умовах України це станеться з вірогідністю 99,9%.
Норма п.7 ст. 56 законопроекту не передбачена в жодних європейських нормативних документах. Вона вводиться в ПЗУ державною контролюючою організацією разом з розробниками законопроекту з метою доступу до чужої власності та подальшого не законного заволодіння нею. Дана норма вводиться виключно для вітчизняних виробників, що є їх дискримінацією та приниженням і ставить в не рівні умови з закордонними виробниками. До контролювання ж якості кінцевого продукту дана вимога не має ніякого відношення.
Наразі ми розглядаємо лише розділ Х законопроекту. Нас не здивує, якщо в інших розділах будуть свідомі чи не свідомі неякісні положення, за якими всім прийдеться жити і працювати. Ми будемо й надалі ділитися своїми думками і висновками до цього та інших нормативних документів.
ВИСНОВКИ. 1. На нашу думку, державні органи, які цілеспрямовано гальмують розвиток цілої галузі, дискримінують і принижують вітчизняних виробників, не мають права на існування.
- Законопроект охоплює всі напрямки ветеринарії та тваринництва в цілому і торкається інтересів широкого спектру фахівців – науковців, виробників ветпрепаратів, практикуючих лікарів ветмедицини, дистриб’юторів ветпрепаратів тощо. Не можна покладатися на «добрих хлопців», які унормують нам життя на багато років на перед. Необхідно долучатися до вивчення документу та надавати свої зауваження для обговорення та внесення правок.
Що ховається за звичайними законодавчими визначеннями (ч.1).
Скрипник В.Г., доктор ветеринарних наук, генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок (Ветпромспілка).
Ветеринарна спільнота вже кілька років очікує на появу нової редакції Закону України «Про ветеринарну медицину». Наразі даний час текст законопроекту розглядається робочою групою при ВР України. Робочих версій законопроекту було кілька. Всі вони розглядалися і активно доопрацьовувалися громадськістю. Комітет безпеки харчових продуктів та ветеринарії Громадської ради при Держпродспоживслужбі на своїх засіданнях напрацював та подав розробникам більше 200 пропозицій. Однак найактивніше обговорювалися пропозиції та зауваження до розділу Х законопроекту, який установлює правила виробництва, реєстрації та обігу ветеринарних препаратів. Переважна більшість пропозицій була узгоджена в процесі обговорення, втім, залишилося кілька моментів, які, в разі їх затвердження, нівелюють більшість прогресивних положень нової редакції закону. Хочу зупинитися на одному формулюванні, проти якого виступають виробники ветеринарних препаратів і за яке «стоять горою» причетні державні структури та, на превелике наше здивування, розробники законопроекту (група юристів під керівництвом Тоні Віла).
Варто пригадати недалеку історію розвитку вітчизняної індустрії виробництва ветеринарних препаратів, то старше покоління пам’ятає, що в часи СРСР Україна мала потужну державну біологічну промисловість – 6 біологічних фабрик, які виготовляли продукцію для всього Радянського Союзу. Тоді вся біологічна промисловість СРСР (в т.ч. і промисловість України) курувалася і контролювалася однією установою – Всесоюзним державним науково-контрольним інститутом ветеринарних препаратів. За роки незалежності у галузі виробництва ветеринарних препаратів України відбулися величезні радикальні зміни. Державна біологічна промисловість практично припинила існування. З шести біологічних фабрик залишилося дві, які ледве зводять кінці з кінцями завдяки державним замовленням. В той же час, з нуля розвинулася потужна (як для України) не державна індустрія виробництва ветеринарних препаратів. Сьогодні приватні вітчизняні підприємства забезпечують майже 100% виробництва препаратів хіміко-фармацевтичної групи та близько 70% імунобіологічних препаратів вітчизняного виробництва і нарощують реалізацію своїх препаратів як у середині держави, так і за кордоном. Фактично індустрія виробництва ветеринарних препаратів в Україні з державної стала приватною. На фоні
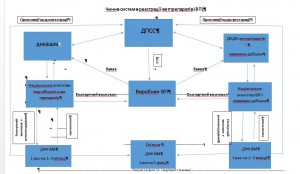
розвитку приватної індустрії виробництва ветеринарних препаратів і занепаду державної, розвивалися державні контролюючі установи і утворення (мал. 1), відшліфовувалися радянські та напрацьовувалися нові методи і механізми контролю за виробництвом. Зі схеми малюнку можна бачити, що за час незалежності в Україні створено два державних науково-контрольних інститути (ДНКІБШМ і ДНДКІ ветпрепаратів і кормових добавок), два Національних агентства ветеринарних препаратів, Державна фармакологічна комісія ветеринарної медицини (ДФК ВМ). Структуру очолює потужна інспекторська служба (ДПСС). При цьому ми маємо кілька суттєвих вітчизняних нюансів.
Нюанс перший: всі державні контролюючі утворення (окрім Держпродспоживслужби) не фінансуються державою, а існують і розвиваються за рахунок платежів за реєстрацію і перереєстрацію ветеринарних препаратів. Нюанс другий: співробітники Національних агентств ветпрепаратів є структурними підрозділами відповідних контрольних інститутів, а експерти агентств – співробітниками інститутів.
Нюанс третій: контрольні інститути мають право ( і успішно ним користуються) розробляти, виготовляти та реалізовувати ветеринарні препарати. При цьому вони самі собі проводять експертизу, самі реєструють свої препарати.
Нюанс четвертий: За час розбудови вітчизняної контролюючої системи сам контроль за ветеринарними препаратами зведено до контролювання легальних виробництв і реєстраційних випробувань легальних препаратів. При цьому у державі не існує жодного контролю за обігом препаратів, зокрема нелегальних. Тому вітчизняний ринок ветеринарних препаратів заполонили препарати невідомого походження і якості – не зареєстровані в Україні, контрабандні та фальсифіковані.
Отже, з одного боку, сьогодні ми маємо «удосконалену» на свій лад радянську державну систему контрою за виробництвом і обігом ветеринарних препаратів, яка є комфортною для державних контролюючих установ. З другого боку – нову не державну галузь, яка потерпає від викривленої, недолугої, громіздкої і не ефективної контролюючої системи.
Але до чого тут новий законопроект? Все дуже просто. Для збереження існуючої ситуації представникам цієї системи необхідно «протягнути» в закон лише одне формулювання:
«88) Національна установа України з ветеринарних препаратів – державна наукова установа, уповноважена здійснювати наукову оцінку (експертизу) ветеринарних лікарських засобів з метою їх державної реєстрації в Україні. Функції Національної установи України з ветеринарних препаратів стосовно ветеринарних імунобіологічних засобів виконує Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів, а стосовно інших ветеринарних лікарських засобів та біоцидів – Державний науково-дослідний контрольний інститут ветеринарних препаратів та кормових добавок, якщо компетентний орган не уповноважив інші наукові установи на виконання відповідних функцій. Компетентний орган може уповноважити різні наукові установи на виконання функцій Національної установи України з ветеринарних препаратів щодо різних видів ветеринарних лікарських засобів».
Це невеличке формулювання на багато років унеможливить цивілізований розвиток системи реєстрації та контролю за обігом ветеринарних препаратів у державі, буде блокувати розвиток виробництва та експортний потенціал компаній. Наша пропозиція:
«88) Національна установа України з ветеринарних препаратів – державна установа, уповноважена здійснювати оцінку (експертизу) ветеринарних лікарських засобів з метою їх державної реєстрації в Україні.»
ВИСНОВОК. Радянська система регулювання ринку ветеринарних препаратів з використанням державних контрольних інститутів себе давно вичерпала. Ситуація, коли державна наукова установа є розробником, експертом, виробником і контролером в одній особі викликає постійний конфлікт інтересів і є не допустимою. Тому систему реєстрації ветеринарних препаратів в Україні треба докорінно змінити.
Наші пропозиції щодо зміни системи реєстрації ветеринарних препаратів напрацьовані і обговорені громадськістю, найближчим часом будуть передані керівництву Держпродспоживслужби.
ПРОБЛЕМИ ПРАВОВОГО РЕГУЛЮВАННЯ СПРОЩЕНОЇ РЕЄСТРАЦІЇ ВЕТЕРИНАРНИХ ПРЕПАРАТІВ В УКРАЇНІ
І. А. Березовська, кандидат юридичних наук, старший науковий співробітник науково-дослідної частини Інституту міжнародних відносин Київського національного університету імені Тараса Шевченка, місто Київ, вул. Ю. Іллєнка, 36/1.
Анотація. Статтю присвячено дослідженню особливостей правового регулювання спрощеної реєстрації ветеринарних препаратів у світлі гармонізації законодавства України із законодавством ЄС. Відзначено, що у зв’язку зі складністю підготовки повного реєстраційного досьє в законодавстві багатьох країн, в тому числі країн Євросоюзу передбачено низку можливостей для спрощеної реєстрації ветеринарних препаратів шляхом подачі скороченого переліку матеріалів реєстраційного досьє.
Здійснено аналіз відповідного законодавства ЄС, зокрема положень Директиви 2001/82 щодо спрощеної реєстрації ветеринарних препаратів. Визначено, що в праві ЄС передбачено можливість подачі неповного досьє у випадках реєстрації генеричних чи гібридних ветеринарних препаратів, ветеринарних препаратів з добре вивченим ветеринарним застосуванням, ветеринарних препаратів з фіксованою комбінацією, ветеринарних препаратів, що реєструються за інформованою згодою.
Доведено, що на сьогодні правове регулювання такої реєстрації в Україні потребує вдосконалення.
КЛЮЧОВІ СЛОВА: ЄВРОПЕЙСЬКИЙ СОЮЗ, ВЕТЕРИНАРНІ ПРЕПАРАТИ, ГАРМОНІЗАЦІЯ ЗАКОНОДАВСТВА, РЕЄСТРАЦІЯ ВЕТЕРИНАРНИХ ПРЕПАРАТІВ, СПРОЩЕНА РЕЄСТРАЦІЯ.
Постановка проблеми. На сьогодні базовою основою обігу фармацевтичних засобів у більшості країн світу є необхідність їх державної реєстрації як обов’язкова передумова легальної появи на ринку. Метою такої реєстрації є надання виробником інформації, що дозволяє оцінити співвідношення користь/ризик по кожному препарату для вирішення питання про його допуск в обіг.
Вперше законодавча вимога підтвердження компаніями-виробниками безпеки їхньої продукції до її появи у продажу була прийнята Конгресом США в 1938 році у відповідь на масове отруєння еліксиром сульфаніламіду [1]. Протягом 20-го століття така реєстрація була запроваджена в законодавство переважної більшості країн світу. Наразі вона передбачає подачу заявником і оцінку компетентними органами матеріалів реєстраційного досьє, підтверджуючих ефективність, безпеку і якість фармацевтичних препаратів як для людей, так і для тварин. При цьому вимоги до змісту і деталізації реєстраційних досьє в різних країнах відрізняються як в цілому, так і стосовно різних видів та типів препаратів. Максимально суворі вимоги до фармацевтичної промисловості діють в країнах Євросоюзу, а також інших розвинутих країнах світу. Проведення реєстрації препаратів тут вимагає від виробників значних фінансових та організаційних ресурсів, а також тривалої підготовки необхідних досліджень.
На практиці тести, доклінічні і клінічні випробовування, пов’язані з реєстрацією ветеринарних препаратів, потребують від компаній-виробників масштабних інвестицій. У зв’язку з цим, в законодавстві багатьох країн, а також в Євросоюзі, передбачається низка можливостей спрощеної реєстрації ветеринарних препаратів шляхом подачі скороченого переліку матеріалів реєстраційного досьє.
Законодавство України також передбачає можливість спрощеної реєстрації ветеринарних препаратів, однак умови та практика її застосування на сьогодні є неоднозначними та не повністю відповідають провідному світовому досвіду. З урахуванням зміни підходів до здійснення національних реєстраційних процедур, що відбуваються останнім часом, особливої актуальності зазначена тема набуває для забезпечення можливості розвитку вітчизняних підприємств ветеринарної фармації.
Аналіз останніх досліджень і публікацій. У вітчизняній доктрині питання правового регулювання фармацевтичної промисловості в ЄС та гармонізації відповідного законодавства України досліджуються переважно стосовно гуманної медицини, зокрема в роботах таких вчених як З. Гладун, О. Пасечник, О. Терехов, Ю. Хом’яко та інш. Практичні аспекти реєстрації ветеринарних препаратів висвітлюються в роботах ветеринарних науковців І. Коцюмбаса, Ю. Косенка, Д. Яновича та інш. В той же час роботи, присвячені аналізу правових засад реєстрації ветеринарних препаратів в Україні, поки що відсутні.
Мета статті. Метою цієї роботи є аналіз основних проблем правового регулювання спрощеної реєстрації ветеринарних препаратів в Україні у світлі гармонізації вітчизняного ветеринарного законодавства із законодавством Євросоюзу.
Виклад основного матеріалу дослідження. Для України, яка внаслідок підписання Угоди про асоціацію з Євросоюзом [2] знаходиться в процесі реформування національного законодавства [3], надзвичайно важливим є вивчення досвіду Євросоюзу для його оптимального використання.
На сьогодні основним документом, що регулює обіг ветеринарних препаратів на рівні Євросоюзу, є Директива Європейського Парламенту та Ради про Кодекс Співтовариства щодо лікарських засобів для ветеринарного застосування № 2001/82/ЄС від 6 листопада 2001 року [4].
Відповідно до ст.5 Директиви 2001/82/ЄС жоден ветеринарний лікарський засіб не може бути розміщений на ринку держави-члена ЄС, якщо уповноважений орган цієї держави-члена ЄС не видав реєстраційне посвідчення в порядку, визначеному законодавством ЄС. При цьому європейське законодавство чітко регламентує перелік вимог до складання документів реєстраційного досьє, що подається заявником.
Вимоги до заявки на отримання реєстраційного посвідчення на ветеринарні препарати (зміст реєстраційного досьє) визначені в ст.12 Директиви №2001/82/ЄС. Така заявка повинна включати всі адміністративні відомості та наукову документацію, необхідну для підтвердження якості, безпечності та ефективності відповідного ветеринарного препарату. Перелік документів, що додаються до заявки визначено в Додатку I до Директиви. На понад 20 сторінках цього документу детально викладені вимоги до змісту реєстраційного досьє.
Повне реєстраційне досьє на ветеринарний препарат включає такі 4 частини:
- Резюме (коротка характеристика препарату, відповідно до вимог ст. 14 Директиви №2001/82/ЄС);
- Якість (фармацевтичні (фізико-хімічні, біологічні або мікробіологічні) дані про активно-діючі речовини та про кінцевий ветеринарний лікарський засіб, в т.ч. відомості про процес виробництва, належну виробничу практику, характеристики та властивості, процедури та вимоги до контролю за якістю, стабільністю, а також опис складу та остаточного вигляду ветеринарного препарату);
- Безпечність (в т.ч результати досліджень на безпечність та наявність залишків, а також оцінки потенційних ризиків, що його становить лікарський засіб для навколишнього середовища);
- Ефективність (в т.ч. фармакологія, результати доклінічних та клінічних досліджень; належна клінічна практика).
При цьому подача повного досьє і проведення всього обсягу досліджень передбачається лише для нових або «оригінальних» препаратів, в той час як для решти препаратів передбачається низка можливостей спрощеної реєстрації ветеринарних препаратів шляхом подачі скороченого переліку матеріалів реєстраційного досьє (неповного досьє), зокрема, у випадках генеричних чи гібридних ветеринарних препаратів, ветеринарних препаратів з добре вивченим ветеринарним застосуванням, ветеринарних препаратів з фіксованою комбінацією, ветеринарних препаратів, що реєструються за інформованою згодою (ст.13, 13а, 13b, 13c Директиви).
Директива чітко закріплює механізм реєстрації препаратів-генериків. Так, відповідно до ст.13 Директиви генерик ветеринарного лікарського засобу розміщується на ринку, не менше ніж через десять років після першої реєстрації еталонного засобу (та 13 років у випадку ветеринарних лікарських засобів для риби або бджіл або інших видів тварин, визначених Комісією ЄС).
В цій же статті закріплено визначення поняття «генерик ветеринарного лікарського засобу», під яким розуміють лікарський засіб, який має такий же якісний та кількісний склад активнодіючих речовин та таку ж лікарську форму, що й еталонний лікарський засіб, та його біоеквівалентність з еталонним лікарським засобом доведена відповідними дослідженнями біодоступності. Солі, ефіри, складні ефіри, ізомери, суміші ізомерів, комплекси або похідні активнодіючих речовин вважаються такою самою активнодіючою речовиною, окрім випадків, коли вони значно відрізняються за властивостями, безпечністю та/або ефективністю. У таких випадках, заявник повинен надати додаткову інформацію з метою доведення безпечності та/або дієвості різних солей, складних ефірів або похідних зареєстрованої активнодіючої речовини».
При цьому в пункті 1 статті 13 Директиви ЄС зазначається, що «…заявник не повинен надавати результати досліджень на безпечність та наявність залишків або результати доклінічних і клінічних досліджень, якщо він може довести, що лікарський засіб є генериком еталонного лікарського засобу, який має дозвіл на використання в Державі-члені ЄС або у Спільноті відповідно до Статті 5 не менше восьми років».
Зазначені положення висвітлюють суть запровадженого в ЄС підходу до реєстрації препаратів – генериків, що передбачає, з одного боку, захист еталонного препарату на період не менше 10 років, а з іншого – спрощує порядок реєстрації препаратів – генериків після закінчення зазначеного періоду захисту.
Відповідно до сучасної міжнародної практики «ідеальний» генерик повинен мати аналогічні оригінальному препарату ефективність і безпеку при проведенні фармакотерапії, тобто бути однаковим в терапевтичному плані [5]. Регуляторні органи (Всесвітня організація охорони здоров’я, Європейське агентство з лікарських засобів (ЕМЕА), Управління з нагляду за якістю харчових продуктів і лікарських засобів (FDA)) вважають доведеною терапевтичну еквівалентність препарату, якщо обґрунтована фармацевтична еквівалентність / альтернативність і проведено одне з досліджень:
- вивчення біоеквівалентності (порівняльне фармакокінетичне дослідження);
- порівняльне дослідження фармакодинаміки;
- порівняльні клінічні випробування;
- тест розчинення in vitro.
Порядок проведення таких досліджень в європейському законодавстві також чітко врегульовано завдяки прийняттю спеціальних настанов. Серед іншого, окремо визначаються випадки, в яких визначення біоеквівалентності не передбачено, зокрема при виготовленні розчинів для парентерального введення, для пиття, газів, лікарських засобів місцевої дії, інгаляційних, назальних спреїв у формі водних розчинів, вушних та очних водних розчинів, водних розчинів для ректального або вагінального застосування.
Регуляторні вимоги стосовно препаратів зі «старими» молекулами дещо інші, оскільки для цих типів ветеринарних препаратів проводиться менший цикл розробки порівняно з інноваційними та генеричними лікарськими препаратами. Докази їх ефективності базуються переважно на даних літературних джерел та досвіду застосування в клінічній практиці протягом багатьох десятирічь [5].
Зокрема, в п. 1 статті 13а Директиви ЄС №2001/82 зазначається, що «… від заявника не вимагають надання результатів досліджень на безпечність та наявність залишків або результатів доклінічних або клінічних досліджень, якщо він може довести, що активні (діючі) речовини ветеринарного лікарського засобу перебували у налагодженому ветеринарному використанні у Спільноті не менше 10 років, були визнані ефективними і такими, що мають прийнятний рівень безпечності відповідно до умов, встановлених у Додатку I. У такому випадку заявник зобов’язаний надати відповідну наукову літературу».
Спеціальними положеннями ст. 13b та 13c Директиви встановлюється порядок спрощеної ветеринарних препаратів з фіксованою комбінацією та ветеринарних препаратів, що реєструються за інформованою згодою.
Слід підкреслити, що відповідно до прийнятої Кабінетом міністрів України Всеохоплюючої стратегії імплементації Глави IV Угоди про асоціацію Директива 2001/82 мала бути імплементована в українське законодавство вже протягом 2018 року [6]. Однак, станом на середину 2019 року така імплементація не була здійснена.
Варто відзначити, що протягом останніх років в самому Європейському Союзі тривала підготовка до реформи законодавства про ветеринарні препарати. Як відомо, досі стандарти їх виробництва там були практично аналогічними зі стандартами виробництва лікарських препаратів для людей. Однак, з урахуванням низки аргументів стосовно суттєвих відмінностей між цими групами препаратів, зокрема щодо способів вживання людських та ветеринарних препаратів, а також у зв’язку із спадом у розвитку ветеринарної фармації протягом останніх років в Євросоюзі виникли активні дискусії про необхідність послаблення стандартів виробництва ветпрепаратів.
Врешті після чотирьох років переговорів 11 грудня 2018 року Європейський Парламент та Рада схвалили Регламент № 2019/6 щодо ветеринарних лікарських засобів та скасування Директиви 2001/82 ЄС [7]. Передбачається, що після закінчення трьохрічного перехідного періоду цей документ має вступити в силу з 28 січня 2022 року. Регламент охоплює всі напрямки здійснення реєстрації ветеринарних препаратів у Союзі – як на централізованому союзному, так – і на національному рівні.
Як і чинна Директива 2001/82 новий Регламент зберігає можливість спрощеної реєстрації. Зокрема, його розділ 5 містить Особливі вимоги до генеричних, гібридних і комбінованих ветеринарних препаратів, а також заявок на основі інформованої згоди і бібліографічних даних.
Відповідно до преамбули прийняття Регламенту має на меті збільшити кількість інновацій у галузі, забезпечити доступність ветеринарних препаратів шляхом спрощення регуляторного тиску та адміністративного навантаження та збільшити конкуренцію у ветеринарному фармацевтичному секторі. Крім того, ключовим моментом у цього документі є посилення чинного законодавства ЄС щодо протимікробної резистентності.
Проведений аналіз свідчить про наявність детального правого регламентування на рівні ЄС реєстраційних процедур, направлених на збереження балансу між забезпеченням безпеки і ефективності ветеринарних препаратів та можливостей для розвитку фармацевтичного виробництва.
Аналізуючи стан правового регулювання вказаних питань в Україні, варто відзначити, що на сьогодні правові основи реєстрації ветеринарних препаратів в Україні визначаються Законом «Про ветеринарну медицину» (ст.63-65) [8]. Зокрема, згідно з п.3 ст. 63 для здійснення державної реєстрації до одного з уповноважених Департаментом[1] державних науково-дослідних контрольних інститутів подається заява разом з відповідними супровідними документами, перелік яких визначає Департамент. Положення про державну реєстрацію ветеринарних препаратів установлює Кабінет Міністрів України.
Безпосередньо спрощеній реєстрації присвячена окрема ст.64 зазначеного Закону, яка передбачає, що для окремих ветеринарних препаратів може запроваджуватися державна реєстрація за спрощеною процедурою.
Пунктом 2 ст.64 уточнюється, що спрощена реєстрація застосовується щодо препаратів, які є «значним чином схожими, містять рівну кількість однаково діючих субстанцій в одній і тій самій формі, результати відповідних досліджень яких підтверджують їх ідентичність щодо біодоступності та біоеквівалентності, а також те, що їх терапевтичний вплив є по суті однаковим з терапевтичним впливом патентованих препаратів (препаратів-брендів), зареєстрованих в Україні та в інших країнах, а також щодо препаратів, визначених Департаментом як такі, що мають однакові критерії для реєстрації».
При цьому Закон покладає функцію здійснення оцінки (експертизи) можливості реєстрації ветеринарних препаратів за спрощеною процедурою на Національне агентство ветеринарних препаратів та кормових добавок або Національне агентство ветеринарних імунобіологічних препаратів, надаючи на це строк протягом 90 днів після отримання повного комплекту реєстраційних документів та проведення відповідної оплати (п.4 ст.64 ЗУ «Про ветеринарну медицину»). При цьому визначено, що Департамент визначає порядок та перелік документів, які подаються для отримання рішення про процедуру спрощеної реєстрації. (п.5 ст.64 ЗУ «Про ветеринарну медицину») [8].
Затверджене на виконання вимог ст. 63 Закону постановою Кабінету Міністрів України від 21 листопада 2007 р. N 1349 Положення про державну реєстрацію ветеринарних препаратів по суті дослівно відтворює статтю 64 Закону щодо спрощеної реєстрації без жодної її деталізації [9].
Як відомо, основним спеціалізованим підзаконним актом, що починаючи з 2008 року регулює порядок формування реєстраційного досьє для ветеринарних препаратів, є Наказ Державного комітету ветеринарної медицини України №133 від 14.07.2008 року «Про затвердження форм заяв, переліку матеріалів реєстраційного досьє та порядку його формування» [10].
Наказ встановлює перелік матеріалів реєстраційного досьє для всіх загальних видів ветеринарних препаратів, окрім тих, вимоги на які регулюються особливим чином: на ветеринарні імунобіологічні препарати, на готові корми для непродуктивних тварин, а також на премікси і кормові добавки. Відповідно до його положень реєстраційне досьє на загальні ветеринарні препарати складається з чотирьох частин: Частина I. Адміністративна; Частина II. Хімічна, фармацевтична і біологічна документація; Частина III. Документація, що підтверджує безпечність та допустимий рівень залишків препарату в продуктах тваринництва; Частина IV. Доклінічна і клінічна документація.
Варто відзначити, що передбачена Наказом №133 структура реєстраційного досьє і перелік документів, що мають до нього входити в цілому відповідає стандартам, що діють в Європейському Союзі відповідно до умов Директиви 2001/82. Однак, по суті цим наказом передбачено подання повного комплекту документації з усіма можливими видами необхідних досліджень, тобто повного реєстраційного досьє без жодного згадування про можливість спрощеної реєстрації шляхом подачі скороченого реєстраційного досьє.
Висновки. Таким чином, по суті на сьогодні діючим законодавством України передбачається можливість спрощеної реєстрації ветеринарних препаратів лише у двох випадках.
По-перше, стосовно генеричних препаратів[2] при умові наявних досліджень їх ідентичності щодо біодоступності та біоеквівалентності з оригінальними препаратами визначеними в законі як «препарати-бренди» (ч.1 п.2. ст.64 ЗУ «Про ветеринарну медицину»). Відсутність у чинному законодавстві чіткого визначення необхідних термінів, вимог до проведення передбачених досліджень та оформлення відповідної документації, а також нездійснення диференціації між різними видами ветеринарних препаратів (зокрема, за тваринами призначення, видами діючих речовин та формою препаратів) є істотною прогалиною в правовому регулюванні, що негативно впливає на діяльність виробників ветеринарних препаратів та не сприяє прозорості реєстраційних процедур. Очевидно, що наявна правова норма вимагає вдосконалення.
По-друге, стосовно препаратів, визначених компетентним у сфері ветеринарних препаратів органом як такі, що мають однакові критерії для реєстрації (ч.1 п.2. ст.64 ЗУ «Про ветеринарну медицину»). Однак, з моменту прийняття відповідної законодавчої норми і до теперішнього часу відповідні нормативні акти компетентним органом не розроблено.
З урахуванням відсутності на сьогоднішній день будь-яких інших документів, прийнятих на виконання ст.63-64 ЗУ «Про ветеринарну медицину» можемо стверджувати про існування суттєвих прогалин в правовому регулюванні спрощеної реєстрації ветеринарних препаратів.
Хоча в загальних рисах українська система реєстрації ветпрепаратів наближена до європейської, однак рівень правового регулювання такої реєстрації в ЄС є значно вищим. Подальша гармонізація потребує ухвалення необхідних національних правових актів, що регулюють обіг ветеринарних препаратів та вдосконалення існуючих інституційних механізмів. Враховуючи обмеженість ресурсів фармвиробників у ветеринарному секторі порівняно з гуманною фармацією саме лише підвищення регуляторних вимог до рівня законодавства ЄС без врахування наявних в ньому спрощень і переваг, а також без комплексного вирішення проблем обігу ветпрепаратів в Україні (вилучення з ринку незареєстрованих препаратів, заборони використання у тваринництві фармацевтичних субстанцій тощо) призведе до знищення вітчизняної ветеринарної фармацевтичної індустрії.
Зокрема, потребує нагального врегулювання питання визначення випадків, у яких можливе проведення державної реєстрації ветеринарних препаратів на підставі даних наявної наукової літератури без додаткового надання заявниками результатів власних досліджень на наявність залишків активно діючих речовин.
Адекватного врегулювання потребують і вимоги до здійснення біоквівалентності та біодоступності і підходи до перереєстрації вже протягом тривалого часу зареєстрованих ветеринарних препаратів.
При цьому має бути знайдено баланс між необхідністю забезпечити високу якість, ефективність і безпеку продукції та збереженням можливості діяльності легальних вітчизняних виробників ветеринарних препаратів.
ЛІТЕРАТУРА:
- Barbara K. Immel A Brief History of the GMPs for Pharmaceuticals [Електронний ресурс]. – Режим доступу: https://www.scribd.com/document/358469747/A-Brief-History-of-GMP.
- Угода про асоціацію між Україною та Європейським Союзом і його державами-членами //Офіційний вісник України від 26.09.2014, № 75, том 1, стор. 83, стаття 2125.
- Березовська І.А. Реформування українського законодавства щодо виробництва ветеринарних препаратів у світлі асоціації України з ЄС // Науково-технічний бюлетень Державного науково-дослідного контрольного інституту ветеринарних препаратів та кормових добавок і інституту біології тварин – Львів, 2017. – Вип.18, №2, с.503 – 510.
- Directive 2001/82 EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to veterinary medicinal products // Official Journal L 311, 28.11.2001, p. 1–66.
- Методичні рекомендації «Сучасні принципи оцінки еквівалентності лікарських засобів в Україні» 77.17/119.17. Київ, 2017 [Електронний ресурс]. – Режим доступу: https://www.apteka.ua/article/431229
- Розпорядження Кабінету Міністрів України від 24 лютого 2016 р. № 228-р «Про схвалення Всеохоплюючої стратегії імплементації Глави IV (Санітарні та фітосанітарні заходи) Розділу IV “Торгівля і питання, пов’язані з торгівлею” Угоди про асоціацію між Україною, з однієї сторони, та Європейським Союзом, Європейським Співтовариством з атомної енергії і їхніми державами-членами, з іншої сторони» // Урядовий кур’єр від 06.04.2016 № 65.
- Regulation (Eu) 2019/6 оf the European Parliament аnd of the Council of 11 December 2018 on veterinary medicinal products and repealing Directive 2001/82/EC // Official Journal L/43 , 7.01.2019.
- Закон України “Про ветеринарну медицину” від 25.06.1992 № 2498-XII // Голос Україниофіційне видання від 24.07.1992.
- Постанова Кабінету міністрів України від 21.11.2007 N 1349 «Про затвердження положень про державну реєстрацію ветеринарних препаратів, кормових добавок, преміксів та готових кормів» //Офіційний вісник України від 03.12.2007 р., № 89, стор. 46, стаття 3273, код акта 41573/2007.
- Наказ Державного комітету ветеринарної медицини України №133 від 14.07.2008 року «Про затвердження форм заяв, переліку матеріалів реєстраційного досьє та порядку його формування» Офіційний вісник Українивід 22.08.2008 р., № 60, стор. 50, стаття 2044, код акта 43987/2008.
[1] В зв’язку з реорганізацією наразі передбачені Законом функції Депарартаменту покладено на Держпродспоживслужбу – прим. автора.
[2] Хоча в тексті ст.64 ЗУ «Про ветеринарну медицину» цей термін не згадується, але зміст його в загальних рисах відповідає поняттю «генерика», визначеного Директивою 2001/82 – прим. автора.
Ринок ветеринарних препаратів України – демократія чи безвідповідальність?
Скрипник В.Г., генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок.
Вже давно є аксіомою той факт, що без якісних (ефективних і безпечних) ветеринарних препаратів неможливий розвиток промислового тваринництва. В Україні після розпаду СРСР народилася, зміцніла і нарощує обсяги виробництва вітчизняна індустрія виробництва ветеринарних препаратів різних форм власності. Вітчизняні препарати успішно конкурують із закордонними аналогами на ринку України та за її межами, поступово завойовуючи ринки інших держав. Але подальший розвиток виробництва гальмується низкою об’єктивних і суб’єктивних факторів. Розглянемо основні з них.
- Очевидно, що без розвитку тваринництва в державі, нарощування обсягів виробництва ветеринарних препаратів сповільнюється. А ми можемо констатувати, що кількість поголів’я тварин у державі неухильно зменшується. Тому виробники змушені завойовувати зовнішні ринки, а це справа не проста і не швидка, хоча і має свої плюси у вигляді підвищення якості продукції, що тягне за собою покращення стандартів виробництва.
- Загальнодержавний занепад фінансової системи, неможливість доступу до кредитних ліній не дає змоги швидко і ефективно проводити модернізацію виробництва і підвищувати стандарти якості продукції.
- Стагнація вітчизняної науки взагалі і ветеринарної зокрема. Наука перестала генерувати нові ідеї, розробляти нові ефективні ветеринарні препарати для промислового виготовлення. Тому виробники були змушені створювати свої наукові підрозділи, спеціальні конструкторські лабораторії, розробляючи ефективні препарати самі або запозичувати імпортні технології. А це, в свою чергу, потребувало затрат часу і капіталовкладень.
- Застаріла і недосконала нормативно-правова база, яка не передбачає активного розвитку даного напрямку господарювання.
Наприклад, в Україні передбачено здійснювати перереєстрацію ветеринарного препарату кожні 5 років до кінця його існування. А в Європейському Союзі вважають достатнім терміном перевірки якості і безпечності препарату 5 років, після чого препарат проходить перереєстрацію з необмеженою дією реєстраційного посвідчення.
На ринку ветеринарних препаратів України знаходяться переважно генеричні препарати (генерик, взаємозамінний), але у законодавстві немає навіть їх визначення. А тому реєструють їх як оригінальні препарати, що потребує надання контролюючій організації значно більшої кількості інформації, коштів і витрат часу для реєстрації.
- Використання субстанцій у якості лікарських засобів.
У світі немає аналогу українському «ноу-хау» – застосуванню для лікування тварин активно діючої речовини (субстанція, АФІ) без використання лікарської форми. У нас досить часто 100% чистий антибіотик використовують для лікування і профілактики хвороб тварин і птиці у промислових масштабах. Тобто, якщо для досягнення терапевтичного ефекту необхідно 5 – 20% діючої речовини, то використання чистої діючої речовини – у 10-20 разів діє сильніше, ніж це необхідно для досягання терапевтичного ефекту. Це негативно впливає на якість тваринницької продукції, а найголовніше – на навколишнє середовище і екологічну безпеку країни. Застосування таких методів лікування тварин призводить до селекції надзвичайно стійких до лікарських засобів штамів мікроорганізмів. Це несе в собі велику загрозу здоров’ю людей. Бо викликавши захворювання у людини такий мікроорганізм не знешкоджується препаратами вибору, хвороба не лікується, а за час, що потрібен для встановлення діагнозу, виділення мікроорганізму та визначення його чутливості до антибактеріальних препаратів можливі тяжкі ускладнення перебігу та летальні наслідки.
- Широке розповсюдження фальсифікованої та контрабандної продукції.
В окремих випадках обсяги фальсифікованої продукції сягають до 60-70% переліку продукції компаній. Такі препарати завдають шкоди здоров’ю тварин, економічних і іміджевих збитків держави в цілому. Чого вартий лише один випадок бракування українського меду в Чехії, коли були знайдені залишки антибіотиків. Розслідування показало, що бджолярі застосовували контрабандні препарати, на маркуванні яких не було вказано про наявність антибіотиків у складі препарату. Навіть поодинокі дослідження ринку ветеринарних препаратів, проведені Державним науково-контрольним інститутом ветеринарних препаратів і кормових добавок, вказують на широку географію контрабандних та фальсифікованих препаратів. Враховуючи обмеженість проведеної роботи можна спрогнозувати, що ця незаконна діяльність перевершує за обсягами діяльність легальну. Тіньовий обіг фальсифікованих і контрабандних ветеринарних препаратів і кормів для тварин сягає сотень мільйонів гривень. Детальніше інформацію можна подивитися на сайті інституту за посиланням www.scivp.lviv.ua.
Виробники фальсифікату та реалізатори контрабанди почуваються вільно, вправно маніпулюють попитом на ринку завдяки низькій ціні (низькопробна продукція дає таку змогу), спокійно живуть через мораторій на перевірки та послаблення ліцензійного законодавства, крадуть інтелектуальну власність, обдурюючи споживачів.
Відповідно до ст. 63 Закону України «Про ветеринарну медицину»: «Ветеринарні препарати до початку їх обігу та використання в Україні проходять державну реєстрацію». За даними ДНДКІ ветпрепаратів і кормових добавок та нашими спостереженнями зараз на ринку ветпрепаратів України знаходиться величезна кількість препаратів, які можна об’єднати під однією назвою – «препарати сумнівної якості». Давайте більш детально розглянемо, що ж це за препарати, як вони попадають на реалізацію і які ризики виникають від їх присутності на ринку та застосуванні.
До групи препаратів сумнівної якості можна віднести препарати не зареєстровані в Україні, препарати просто фальсифіковані (підроблені під відомі бренди) та препарати контрабандні (ті ж не зареєстровані в Україні препарати, але іноземного походження). Якщо опустити юридичні тонкощі у формулюваннях, то з точки зору безпечності для тварин, людей, довкілля та ефективності (корисної дії) ці препарати майже ідентичні та не мають законного права на реалізацію для споживачів.
Контрабандні препарати. Препарати які ввезені на територію України без необхідного законного перетину кордону і, як правило, не мають реєстрації в Україні. Ці препарати можуть бути як оригінальними, так і підробленими, але гарантії щодо їх якості немає в жодному випадку. Ніхто не знає (крім первинного реалізатора, звісно) у який спосіб ці препарати доставлялися в Україну, які перепади температур витримували, яка їх кінцева якість і безпечність. Тобто тут кінцевий споживач ризикує отримати або оригінальний неякісний препарат, або фальсифікований неякісний препарат, або ж препарат, випадково, може бути і якісним. Грубо кажучи, маємо 70:30 за те, що препарат не буде відповідати необхідним параметрам якості і безпечності.
Фальсифіковані препарати. Як правило, фальсифікацію (підробку) препарату здійснюють тоді, коли препарат відомий на ринку і добре реалізується, тобто має швидку окупність і є економічно вигідним вкладенням. При сьогоднішніх технічних можливостях підробити пакування і маркування оригінальних препаратів досить легко. Ризики для кінцевого споживача надзвичайно високі. У кращому випадку такі препарати будуть нешкідливими для тварин і людей. Бо витримувати оригінальну технологію виготовлення і рецептуру препарату буде економічно невигідно. Препарати, відверто підроблені під відомі бренди, в більшості випадків, містять недостатню кількість діючої речовини, а досить часто взагалі її не мають у своєму складі. В кращому випадку це індиферентні розчини (вода, фізрозчин) або наповнювачі (крейда). Відрізнити такі препарати від оригінальних споживачу вкрай важко або неможливо.
Відповідно ст. 66 Закону України «Про ветеринарну медицину»: «Виробництво ветеринарних препаратів, у тому числі фасування та інша діяльність, пов’язана з випуском препаратів, повинно забезпечувати всі стадії технологічного процесу». А тому така поширена діяльність як перефасування оригінальних препаратів є незаконною, а перефасовану продукцію можна вважати фальсифікованою (підробленою). В усьому світі фірма-виробник оригінального препарату видає дозвіл на перефасування свого продукту. А для проведення такої діяльності необхідно мати ліцензію. За нашими даними, в Україні жоден виробник світових брендів таких дозволів жодній українській компанії не давав. Тому препарати розфасовані по 1, 2 .5 , 10 і т.п. мілілітрів (чи грамів) є самодіяльністю наших вітчизняних виробників. В чому полягають ризики споживачів. Все у тій же відсутності гарантії якості (ефективності) і нешкідливості. Препарати, перефасовані без дозволу і контролю виробника, як правило, із оптових об’ємів (бочка, каністра, мішок тощо) до дрібних (ампула, флакон, дозований пакет тощо), несуть у собі чималу загрозу для здоров’я тварин. Перш за все, ніхто не знає, в яких умовах відбувалося перефасування. Тому ймовірною є загроза контамінації (забруднення) якісного препарату мікрофлорою навколишнього середовища (грубо кажучи, мікрофлорою сараю чи гаража, де «виготовляють» таку продукцію) до банального механічного забруднення (від недомитих флаконів, ампул, нестерильних пакетів, рук фасувальників). По-друге, для перефасування ніколи не використовують сертифіковану первинну упаковку (ампули, флакони, пакети), що призводить до втрати ефективності препарату, за рахунок хімічної взаємодії самого препарату з упаковкою, або навіть до утворення шкідливих солей. По-третє, ніхто не знає що і якої якості розфасовано в ампули, флакони чи інше пакування і замість оригінального препарату споживач може отримати наприклад, якесь індиферентне плацебо (вода, фізрозчин чи крейду і т.п.). По-четверте, залишається відкритим питання стерильності і нешкідливості таких препаратів.
Не зареєстровані в Україні препарати. Як зазначалося вище, ветеринарні препарати до початку їх обігу та використання в Україні проходять державну реєстрацію, яку здійснюють відповідні контрольні інститути. Реєстрація підтверджує на державному рівні зазначені якість та безпечність препарату та мінімізує ризики для споживачів. Не зареєстрований препарат також є на ринку, але ніхто офіційно не може підтвердити його якісні характеристики, ефективність і безпечність для тварини, людини, навколишнього середовища. Тобто це щось з невідомою якістю і безпечністю, виготовлене за невідомою технологією, у невідомих умовах, без жодної гарантії відповідності вмісту упаковки заявленим написам на ній та листівці-вкладці (інструкції по застосуванню). Напевно «це щось» не може пройти відповідних державних реєстраційних випробувань, а тому і реалізується без реєстрації. Тому споживач, використовуючи не зареєстровану в Україні продукцію, знову ризикує своїми грошима і здоров’ям своїх тварин, а через продукцію тваринництва і здоров’ям людей.
Сьогодні в Україні склалася така ситуація, що абсолютно відсутній контроль та нагляд за обігом препаратів на ринку, відзначається наростаючий і загрозливий ріст виходу на ринок України незареєстрованих, неякісних та фальсифікованих, контрабандних ветеринарних препаратів. При цьому суттєве збільшення такої продукції спостерігається після введення мораторію на здійснення державного нагляду і контролю за їх якістю і безпечністю. Кількість таких препаратів на ринку рахується сотнями найменувань. Така практика призводить до знищення офіційного виробництва ветеринарних препаратів, нехтування обов’язковими технологічними вимогами виробництва та відкрила шлях для нічим і ніким не контрольованих масштабних контрафактних виробництв. Не маючи належної освіти і кваліфікації, порушуючи ветеринарно-санітарні та нормативно-технічні вимоги, підприємці здійснюють виробництво та реалізацію ветеринарних препаратів сумнівної якості. Це, у свою чергу, призводить до порушення принципу єдиної системи організаційних та кваліфікаційних підходів та вимог у наданні ветеринарних послуг, дестабілізації конкурентоспроможності ринку, порушує строки очікування після застосування препаратів, потрапляння антибактеріальних препаратів та інших ксенобіотиків до продуктів харчування тваринного походження. В результаті – погіршення здоров’я нації в цілому.
Вітчизняна законодавчо-нормативна база не має ефективних важелів боротьби з продукцією сумнівної якості для ветеринарного призначення. Тому удосконалення ветеринарної законодавчо-нормативної бази зі змінами у адміністративний та кримінальний кодекси могло б принести значну користь і для здоров’я тварин, і для здоров’я людей, зберегти навколишнє середовище, і просто поповнити бюджет країни за рахунок легальних податків.
Отже, проблеми розвитку вітчизняної індустрії ветеринарних препаратів і пов’язаної з ним проблеми забезпечення людей якісними продуктами тваринництва, мають комплексний характер. І для їх вирішення необхідний комплексний підхід і увага як держави так і суспільства в цілому. Бо від невирішеності цих проблем потерпають, перш за все, громадяни України.
Нижче наводимо перелік не зареєстрованих ветеринарних препаратів та підприємств, які їх виробляють, виявлені на інтернет-ринку України, наданий в додатку до офіційного листа ДНДКІ ветпрепаратів і кормових добавок:
ДОДАТОК
до листа № 3208-В від _02.08.16
| № з/п | Назва препарату | Виробник препарату |
| 1. | Тривітамін П оральний | ЗАТ “Агрофарм”, Росія |
| 2. | Тривітамін для ін’єкцій | ЗАТ “Агрофарм”, Росія |
| 3. | Глобкан – 5 | “НВО НАРВАК”, Росія |
| 4. | Флуніджект | НПО “Аpі-Sаn”, Росія |
| 5. | Гепатоджект | НПО “Аpі-Sаn”, Росія |
| 6. | Лобелон | ГК “Хелвет”, Росія |
| 7. | Aloxan (Алоксан) | “EW Nutrition GmbH”, Німеччина |
| 8. | Espree Paw Balm (Еспрі, бальзам) | “Espree”, США |
| 9. | ZOODERM (Зоодерм) | ЗАТ “Топ-Вет”, Росія |
| 10. | Доксидев | ТОВ “ДЕВІЄ”, Україна |
| 11. | Емпробіо | ТД “ГЕОТЕК”, Україна |
| 12. | Мазь Вишневського | ПП “O.L.KAR- АгроЗооВетСервіс”,Україна |
| 13. | Артроглікан | ТОВ “Біоцентр”, Росія |
| 14. | Анандін | НИО “МЕДІТЕР” ТОВ, Росія |
| 15. | Cerenia (Серенія) | “Pfizer”, Німеччина |
| 16. | Depo-Promone (Депо-промон) | “Pfizer”, Німеччина |
| 17. | SEEALGENMEHL (Сеангелмен) | “Сanina”, Німеччина |
| 18. | Advanced (Адвансід) | “NUTRI VET”, США |
| 19. | Pappee-vet (ПАППИ-ВИТ) | “NUTRI VET”, США |
| 20. | KalmVet (заспокійливе для собак і котів) | “VetExpert” (Vet Planet Ltd), Польща |
| 21. | VetoMune (засіб для підтримки імунітету у собак і котів) | “VetExpert” (Vet Planet Ltd), Польща |
| 22. | VetoSkin (вітаміни для шкіри і шерсті для собак і котів) | “VetExpert” (Vet Planet Ltd), Польща |
| 23. | Alu-Farm (Алю-Фарм спрей) | “Grupa Vetos Farma”, Польща |
| 24. | Бипин-Т | ТОВ Коллен м. Бровари, Україна |
| 25. | Аллергостоп | ПП “O.L.KAR- АгроЗооВетСервіс”,Україна |
| 26. | Биопримэкстра | ГК “bionit”, Росія |
| 27. | Біпін | ДВП “СКІФ”, Україна |
| 28. | Біпін — Т | ДВП “СКІФ”, Україна |
| 29. | Тактик | ДВП “СКІФ”, Україна |
| 30. | Біпін — І | ТОВ “Базальт”, Україна |
| 31. | Бровафом | ТОВ “Базальт”, Україна |
| 32. | Окситетрацикліну гідрохлорид 20 % | ТОВ “Базальт”, Україна |
| 33. | Диоксинор | ТОВ “Зооветерианарний центр”, Україна |
| 34. | Енрофлоксацинвет 10 % | Невідомий виробник, Україна |
| 35. | Міліколівет колістину сульфат | Невідомий виробник, Україна |
| 36. | Куртикол | ГК “Хелвет”, Росія |
| 37. | Унисан | НПО “Api-San”, Росія |
| 38. | Мастисан-А | ЗАТ “Нита-Фарм”, Росія |
| 39. | ЭКС-5 | ООО «БельБаст» , Росія |
| 40. | Atropinum compositum | “Biologische Heilmittel Heel GmbH”,Німеччина |
| 41. | Belladonna-Homaccord | “Biologische Heilmittel Heel GmbH”,Німеччина |
| 42. | Амоксицилін ультра | ПП “O.L.KAR- АгроЗооВетСервіс”,Україна |
| 43. | Мазь лікасептал | ТОВ “Круг”, Україна |
| 44. | Реосорбілакт | ТОВ “Юрія Фарм”, Україна |
| 45. | Тринорм | “Экохимтех”, Росія |
| 46. | Релакс | “Sanal”, Голандія |
| 47. | САНАЛ вітаміни для котів SANAL Seaweed №100 | “Sanal”, Голандія |
| 48. | Ветспокоїн | НПО “Api-San”, Росія |
| 49. | Аверсект-2 | ТОВ “Фармбіомедсервіс”, Росія |
| 50. | Утерогін | ГК “Хелвет”, Росія |
| 51. | Мігстім | ТОВ “АВЗ”, Росія |
| 52. | Екофітол | ЗАТ “Агробіопром”, Росія |
| 53. | Керолан (Kerolan spray) | “Aveflor”, Чехія |
| 54. | Клавасептин (Clavaseptin) | “Vetoguionol”, Франція |
| 55. | КонтрСекс | НВП Астрафарм, Росія |
| 56. | Карли-Фламинго для очей (Karlie-Flamingo) | “Karlie Flamingo”, Німеччина |
| 57. | Карли-Фламинго для вух (Karlie-F 1 amingo) | “Karlie Flamingo”, Німеччина |
| 58. | Клоксерат Плюс МС | “Норбрук Лаб”, Північна Ірландія |
| 59. | Санрой | НПО “Апі-Сан”, Росія |
| 60. | Флувалідез | ТОВ “Агробіопром”, Росія |
| 61. | Лактоклокс | “Global-Vet”, Великобританія |
| 62. | Утеротон | ТОВ “НІТА-ФАРМ”, Росія |
| 63. | Оварин | ТОВ “РЕПРОВЕТ”, Росія |
| 64. | Тіамутин (Tiamutin) | “NOVARTIS”, Словенія |
| 65. | Прімавет 10% | “Centrovet”, Чилі |
| 66. | Страйд плюс (STRIDE Plus) | “TRM”, Ірландія |
| 67. | Перлутекс (Perlutex) | “Dechra”, Данія |
| 68. | Депедин Вейке (Depedin Veyx) | “Вейкс-Фарма”, Німеччина |
| 69. | Імідосан | “Ветбіохім”, Росія |
| 70. | Глистогон | “НВФ Екопром”, Росія |
| 71. | Мастоміцин | “ЗАТ Ніта-Фарм”, Росія |
| 72. | Гетеротон | ГК “Bionit”, Росія |
| 73. | Метролек — О | ГК “Bionit”, Росія |
| 74. | Метростим | ТОВ “АгроСфера”, Росія |
| 75. | Акутол | “Aveflor”, Чехія |
| 76. | Авейодін | “Aveflor”, Чехія |
| 77. | Фоллігон (Folligon) | “Intervet”, Нідерланди |
| 78. | Здорові очі Eye Cleanse | “Nutri-Vet”, США |
| 79. | Демос | НПО “Api-San”, Росія |
| 80. | БлохНєт | “Астрафарм”, Росія |
| 81. | Клоблаух (Kloblauch) | “Canina”, Німеччина |
| 82. | Петвітал Дерм – капс | “Canina”, Німеччина |
| 83. | Педіатрівет (PediatriVet) | “VetExpert”, Польща |
| 84. | Креолін | Завод “Ветеринарні препарати”, Росія |
| 85. | Елвестін | ТОВ “АлексАнн” Хелвет, Росія |
| 86. | Імунофан | ТОВ “БІОНОКС”, Росія |
| 87. | Сульф – 120 для собак | ТОВ “АВЗ”, Росія |
| 88. | Сульф – 120 для котів | ТОВ “АВЗ”, Росія |
| 89. | Дімінакел плюс (Diminakel plus) | “KELA”, Бельгія |
| 90. | Апі стоп | ЗАТ “Агробіопром”, Росія |
| 91. | Мастім | ФКП “Щолківський біокомбінат”, Росія |
Недолугість держави чи цілеспрямована дискримінація вітчизняних виробників?
Скрипник В.Г., генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок.
Недержавна індустрія виробництва ветеринарних препаратів бере свій початок у 90-х роках минулого сторіччя. З цей час в Україні сформувалися і активно розвиваються компанії, які виробляють і реалізують свою продукцію ветеринарного призначення. Вісім передових, прогресивних і відповідальних компаній об’єдналися в Українську асоціацію виробників і дистриб’юторів ветеринарних препаратів та кормових добавок. Ці компанії мають передові технології виробництва, необхідне обладнання, навчений персонал. Вони приділяють велику увагу безпечності, якості та ефективності виготовленої продукції, яка не поступається за цими показниками закордонним аналогам. А тому цілком закономірно частка вітчизняних препаратів на ринку невпинно зростає. В 2016 році вперше було зареєстровано вітчизняних препаратів більше, ніж імпортних. Продовжується освоєння закордонних ринків. І сьогодні наші виробники реалізують свою продукцію у більш, ніж 20 країнах Азії, Африки, Близького Сходу, країн СНД. На закордонні ринки виведено близько 200 найменувань продукції українських виробників.
Аналізуючи вітчизняну нормативно-правову базу що регламентує виробництво та обіг ветеринарних препаратів не покидає думка, що її формували люди, які недолюблюють вітчизняних виробників. Інакше як пояснити низку несумісних з логікою положень, викладених у законах та підзаконних актах і просто відомчих наказах?
До цього часу основним законом, який якось регламентує діяльність щодо виробництва і обігу ветеринарних препаратів, кормових добавок і кормів для тварин (далі – ветеринарні препарати) є Закон України «Про ветеринарну медицину» (Закон). І саме він визначає подальшу діяльність по розробці, реєстрації, виробництву та контролюванню обігу ветеринарних препаратів. Розглянемо лише декілька формулювань (Таблиця 1).
Прикладом дискримінації та утиску вітчизняних виробників ветеринарних імунобіологічних препаратів може слугувати наказ Державного департаменту ветеринарної медицини Міністерства аграрної політики і продовольства України від 4 грудня 2002 р. № 70, зокрема його розділ 5.
Так п. 5.1 передбачає для транспортування штамів мікроорганізмів територією України дозволи Головного державного інспектора ветеринарної медицини України, керівника установи за погодженням з Державним департаментом ветеринарної медицини, Міністерства екології та природних ресурсів України. Тобто, щоб доставити свої власні штами мікроорганізмів з лабораторії (музею) до виробничих потужностей (біологічної фабрики) необхідно декілька місяців на збирання дозволів.
Таблиця 1. Порівняння формулювань у вітчизняному законодавстві і законодавстві ЄС.
| Формулювання ЗУ «Про ветеринарну медицину» | Формулювання законодавства ЄС | Примітка |
| ветеринарні імунобіологічні засоби – засоби, отримані з використанням біологічних агентів за допомогою біотехнології, терапевтична та/або діагностична дія яких спрямована на корекцію (стимуляцію, модуляцію), а також діагностику імунної системи та виявлення збудників інфекційних хвороб тварин. | ветеринарний імунологічний засіб – засіб, що призначений для використання на тваринах з метою формування активного чи пасивного імунітету або діагностування його стану | У ЄС імунологічний засіб, це засіб, що використовується виключно на тваринах (in vivo). Все інше – від лукавого. |
| ветеринарні препарати – ветеринарні лікарські засоби, ветеринарні імунобіологічні засоби, антисептики, дезінфектанти, інсекто-акарициди, дератизациди, діагностикуми, що використовуються у ветеринарній медицині та тваринництві | ветеринарний лікарський засіб – будь-яка речовина або поєднання речовин, що можуть бути використані для тварин або введені тваринам з метою відновлення, корекції або зміни фізіологічних функцій внаслідок фармакологічної, імунологічної або метаболічної дії, або з метою встановлення медичного діагнозу | Все, що не стосується безпосередньої дії на тварину не є ветеринарним препаратом. А тому діагностичні тест-системи, дератизациди, дезінфектанти, інсекто-акарициди тощо, які не застосовуються на тваринах – це не ветеринарні препарати! |
| Ветеринарні препарати до початку їх обігу та використання в Україні проходять державну реєстрацію. Максимальний термін дії реєстрації становить п’ять років. | Реєстраційне свідоцтво може бути поновлене через п’ять років. І після перереєстрації, термін дії реєстраційного свідоцтва є необмеженим | Тобто, у нас кожні 5 років виробник повинен проводити перереєстрацію своїх препаратів, а це величезні кошти нізащо. |
| При реєстрації вітчизняного ветеринарного імунобіологічного засобу заявник повинен депонувати штами (культури) мікроорганізмів, які використовуються при виробництві та контролі такого імунобіологічного засобу, в Національному центрі штамів мікроорганізмів | Немає такої вимоги | Відповідно до ст. 41 Конституції України визначено, що: кожен має право володіти, користуватися і розпоряджатися своєю власністю, результатами своєї інтелектуальної, творчої діяльності. Ніхто не може бути протиправно позбавлений права власності. Право приватної власності є непорушним |
П. 5.2 передбачає, що «…одержання таких (штамів мікроорганізмів) з-закордону дозволяється проводити Державному науково-контрольному інституту біотехнології і штамів мікроорганізмів за вказівкою Державного департаменту ветеринарної медицини України та дозволом Державної служби експортного контролю». Але щоб провести наукові дослідження по розробці ветеринарного препарату чи організувати випуск такого препарату виробник (розробник) сам знаходить необхідні штами у світових колекціях, домовляється про їх надання, сплачує певні кошти за штами та їх доставку міжнародною акредитованою компанією. При цьому попередньо треба мати дозвіл на наукову розробку (бо без штамів мікроорганізмів її виконати неможливо) і виробництво від 3 державних установ, одна з яких – Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів, сама розробляє і виготовляє ветеринарні препарати.
П. 5.4 регламентує, що «Представники …й інших установ при відрядженнях за кордон можуть отримати там еталонні штами вірусів, бактерій, грибів…. а також препарати з них ….. зобов’язані здати їх у Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів за актом. Надалі ці культури використовуються….. тільки з дозволу Державного департаменту ветеринарної медицини України». Цей пункт дискримінує виробників і розробників ветеринарних препаратів. Доставити в Україну штами мікроорганізмів може лише акредитована міжнародна організація, а ніякий не науковець у власній кишені. Компанію, яка знайшла необхідні штами у світових колекціях, домовитися про їх надання, сплатила кошти за штами та їх доставку, зобов’язують свою власність здати у Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів за актом, а надалі використовувати тільки з дозволу Державного департаменту ветеринарної медицини України.
П. 5.5 передбачає, що «Науково-дослідні, навчальні інститути, виробничі та інші установи………. можуть робити запит на еталонні штами бактерій, вірусів …… тільки через Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів з дозволу Державного департаменту ветеринарної медицини України. Виходячи з цього формулювання та враховуючи пункти наведені вище, видно, що всі установи України повинні погоджувати свої наукові і виробничі плани з Державним науково-контрольним інститутом біотехнології і штамів мікроорганізмів та отримувати від нього благословення у вигляді різних дозволів.
Крім цього, наказ містить безліч інших застарілих вимог, з якими кожен бажаючий зможе ознайомитися, прочитавши наказ сам.
На фоні попереднього наказу досить пристойно, на перший погляд, виглядає наказ Державного департаменту ветеринарної медицини України від 10.03.2005 № 21 «Про затвердження Порядку проведення атестації відділів біологічного контролю підприємств-виробників ветеринарних імунобіологічних препаратів та Порядку проведення атестації виробництв ветеринарних імунобіологічних препаратів». Його гучна назва вводить в оману багатьох неспокушених виробництвом ветпрепаратів людей. Неначе все добре, але все, що в ньому викладено, стосується лише вітчизняних імунобіологічних препаратів!!! Пункт 1 цього Наказу затверджує Порядок проведення атестації відділів біологічного контролю (ВБК) лише вітчизняних підприємств виробників ветеринарних імунобіологічних препаратів (ВІП) та Порядок проведення атестації лише вітчизняних виробництв ветеринарних імунобіологічних препаратів. (Тобто не передбачається атестувати вітчизняних виробників хіміко-фармацевтичних препаратів і ніяких закордонних виробників. Зрозуміло, що Наказ виписаний під конкретну установу – Державний науково-контрольний інститут біотехнології і штамів мікрорганізмів). Такий наказ є дискримінуючим по відношенню до вітчизняних виробників ВІП і суперечить Закону України «Про ветеринарну медицину» де здійснення державного ветеринарно-санітарного контролю та нагляду за виробництвом ветеринарних препаратів, здійснюють Державні інспектори ветеринарної медицини та уповноважені лікарі ветеринарної медицини. Але співробітники Державного науково-контрольного інституту біотехнології і штамів мікрорганізмів не являються Державними інспекторами ветеринарної медицини.
Таких прикладів можна навести ще багато. Декілька з них наведено нижче (Таблиця 2).
Деякі вимоги вітчизняної нормативно-правової бази для ветеринарних препаратів
| Вимоги | Вітчизняний виробник | Закордонний виробник |
| Депонування штамів микроорганизмів при реєстрації ВІП
ЗУ «Про ветеринарну медицину»; Постанова КМУ № 1349 від 21.11.2007 р.; Наказ Головного держінспектора ветмедицини №5 від 17.01.2001; Наказ Головного держінспектора ветмедицини №27 від 12.03.2001 |
Обов’язково.
Реєстрація ВІП без депонування неможлива. |
Не обов’язково, вимоги відсутні. |
| Атестація ВБК
Наказ Держдепартаменту вет медицини № 21 від 19.03.2005 |
Обов’язково.
Реєстрація ВІП без атестації неможлива. |
Не обов’язково, вимоги відсутні. |
| Атестація виробницва
Наказ Держдепартаменту вет медицини № 21 від 19.03.2005 Наказ Держкомітету ветмедицини №133 від 14.07.2008 |
Обов’язково.
Реєстрація ВІП без атестації неможлива. |
Не обов’язково, вимоги відсутні. |
| Обов’язкове контролювання якості в ДНКІБШМ при закупівлі ВІП за кошти держбюджету
Наказ Головного держінспектора ветмедицини №89 від 13.07.2009 |
Обов’язково.
|
Не обов’язково, вимоги відсутні. |
| Отримання виробничих штамів мікроорганізмів з колекцій за дозволом та їх передавання до ДНКІБШМ
Наказ Держдепартаменту вет медицини № 70 от 04.12.2002 |
Обов’язково. | Не обов’язково, вимоги відсутні. |
Якщо уважно прочитати вищенаведене, то стає зрозумілим, що така номативна база не з’явилася зненацька. Вона формувалася цілеспрямовано і послідовно. А враховуючи те, що більшість дискримінативних положень стосуються лише вітчизняних імунобіологічних препаратів (ВІП), стає зрозумілим чому вітчизняна ветеринарна біологічна промисловість знаходиться в такому жалюгідному стані, а більшість існуючих препаратів не є конкурентоздатними.
Ніде у світі неможлива ситуація коли державний контролюючий орган є одним із найбільших розробників і виробників продукції, яку сам реєструє і контролює. А врахувавши той факт, що співробітники цієї установи є науковими співробітниками, які займаються розробкою своїх імунобіологічних препаратів, а паралельно є експертами всіх інших ВІП і мають повний доступ до дос’є на будь-який зареєстрований препарат, маємо повний конфлікт інтересів. І, як показує життя, інтереси вітчизняних виробників страждають не залежно від форми власності виробництва.
Установа, яка призвана стояти на сторожі інтересів держави з забезпечення її епізоотичного благополуччя, а для цього має монопольне право на реєстрацію ВІП, контролювання їх безпечності та якості, депонування штамів мікрорганізмів і контролювання їх руху, атестування ВБК і виробництв – де-факто не є державною! Бо установа сама собі заробляє на виживання, переважно за рахунок виробників і дистриб’юторів ВІП. Тобто є повноцінною бізнес структурою з державними повноваженнями! Уявіть собі ситуацію, коли ДФСУ чи митна служба не отримують державного фінансування, а є госпрозрахунковими та заробляють собі на виживання? А у ветеринарній медицині така ситуація – стандартна річ багато років. На жаль цього не розуміють у державному органі, який формує державну політику в галузі ветеринарної медицини, влаштовує така ситуація і контролюючий орган. Але чи має так бути?
В програші залишаються не лише легальні виробники ветеринарних препаратів, що створюють робочі місця та сплачують податки в Україні, а й вітчизняні споживачі, які змушені значно переплачувати за імпортні препарати.
Правові основи гармонізації законодавства України щодо обігу ветеринарних препаратів з правом Європейського Союзу (ЄС) в контексті укладання угоди про асоціацію були висвітлені в статті Березовської І.А., розміщеній в вересневому номері журналу «Тваринництво сьогодні» №7, 2013 року.
В ній зазначалось, що правове регулювання обігу ветпрепаратів в Євросоюзі базується на таких принципах:
– ветеринарні препарати, дозволені для продажу на європейському ринку, виготовляються лише виробниками, що мають відповідну ліцензію на виробництво (manufacturing authorization), діяльність яких регулярно інспектується компетентними уповноваженими органами;
– кожен ветеринарний препарат, що виробляється, має бути зареєстрованим, тобто мати реєстраційне посвідчення[1] (marketing authorization), що засвідчує проведення його експертизи у компетентному уповноваженому органі;
– якість лікарських засобів для ветеринарії забезпечується дотриманням виробником вимог належної виробничої практики (GMP);
– високий рівень якості вироблених ветеринарних препаратів підтримується в мережі дистрибуції, завдяки дотриманню постачальниками вимог належної виробничої практики (GDP).
Подібні принципи щодо ліцензування виробництва та реєстрації ветпрепаратів діють і в Україні. Однак стандарти їх здійснення в ЄС суттєво відрізняються від українських реалій.
Метою цієї статті є аналіз особливостей процедури реєстрації ветеринарних препаратів в Євросоюзі як однієї зі складових обігу та забезпечення якості ветеринарних препаратів. Окрема увага приділяється законодавчим положенням, що не мають аналогів в українському ветеринарному законодавстві.
На сьогодні порядок реєстрації ветеринарних препаратів в Євросоюзі регулюється такими актами вторинного права ЄС:
– Директива Європейського Парламенту та Ради про Кодекс Співтовариства щодо лікарських засобів для ветеринарного застосування № 2001/82/ЄС від 6 листопада 2001 року (з останніми змінами 2009 року);
– Директива Комісії №2009/9/EC від 10 лютого 2009 року, що вносить зміни до Директиви 2001/82/ЕС про Кодекс Співтовариства щодо лікарських засобів для ветеринарного застосування;
– Регламент Ради №726/2004 від 31 березня 2004, що визначає процедури Співтовариства щодо реєстрації і контролю лікарських засобів для людей та лікарських засобів ветеринарного призначення та створення Європейського агентства лікарських засобів.
Ці документи входять до Volume 5 – Pharmaceutical legislation Medicinal Products for veterinary use (Том 5 Фармацевтичне законодавство про лікарські засоби для ветеринарного застосування), що є складовою частиною загального документу “The Rules Governing Medicinal Products in the European Union” (“Правила регулювання лікарських засобів в Європейському Союзі”).
Відповідно до ст.5 Директиви 2001/82/ЄС жоден ветеринарний лікарський засіб не може бути розміщений на ринку держави-члена ЄС, якщо уповноважений орган цієї держави-члена ЄС не видав реєстраційне посвідчення в порядку, визначеному законодавством ЄС. При цьому європейське законодавство чітко регламентує перелік вимог до складання документів реєстраційного досьє, що подається заявником для реєстрації відповідного ветеринарного препарату. Передбачена директивою складна процедура реєстрації ветеринарних препаратів має на меті гарантувати високу якість, безпечність та ефективність ветеринарних препаратів, що використовуються у Євросоюзі.
Інституційний механізм, відповідальний за здійснення реєстраційних процедур в ЄС, включає такі органи як: Європейська Комісія, Європейське агентство лікарських засобів (ЄАЛЗ) представлене Комітетом з лікарських засобів ветеринарного призначення, а також 42 національних агентства.
Чинне законодавство ЄС передбачає можливість використання таких видів реєстраційних процедур:
- національна процедура – передбачає отримання заявником реєстраційного посвідчення на ветеринарний препарат, чинного лише в одній державі-члені ЄС. На сьогодні така процедура має досить обмежений характер.;
- централізована процедура – передбачає отримання заявником від ЄАЛЗ одного реєстраційного посвідчення чинного на території всіх держав-членів ЄС. Однак така процедура може застосовуватись лише для інноваційних та біотехнологічних препаратів.;
- децентралізована процедура та система взаємного визнання – заснована на взаємному визнанні іншими державами ЄС реєстраційного посвідчення, отриманого заявником в одній чи декількох державах ЄС. Наразі така процедура застосовується в Євросоюзі приблизно до 90% ветеринарних препаратів.
Слід відзначити, що з 2010 року Єврокомісія за сприяння Всесвітньої організації охорони здоров’я тварин (IFAH-Європа) розпочала підготовку реформи законодавства ЄС щодо реєстрації ветпрпаратів. Вона передбачає спрощення реєстраційних процедур, шляхом запровадження для всіх ветеринарних лікарських засобів “Концепції 1-1-1”, яка означає: одне реєстраційне досьє, одна експертна оцінка і одне рішення про видачу реєстраційного посвідчення, чинного на території всіх держав ЄС.
Вимоги до заявки на отримання реєстраційного посвідчення на ветеринарні препарати (зміст реєстраційного досьє) визначені в ст.12 Директиви №2001/82/ЄС. Така заявка повинна включати всі адміністративні відомості та наукову документацію, необхідну для підтвердження якості, безпечності та ефективності відповідного ветеринарного препарату. Перелік документів, що додаються до заявки визначено в Додатку I до Директиви. На понад 20 сторінках цього документу детально викладені вимоги до змісту реєстраційного досьє.
Повне реєстраційне досьє на ветеринарний препарат включає такі 4 частини:
- Резюме (коротка характеристика препарату, відповідно до вимог ст. 14 Директиви №2001/82/ЄС);
- Якість (фармацевтичні (фізико-хімічні, біологічні або мікробіологічні) дані про активно-діючі речовини та про кінцевий ветеринарний лікарський засіб, в т.ч. відомості про процес виробництва, належну виробничу практику, характеристики та властивості, процедури та вимоги до контролю за якістю, стабільністю, а також опис складу та остаточного вигляду ветеринарного препарату);
- Безпечність (в т.ч результати тестування на безпечність та наявність залишків, а також оцінки потенційних ризиків, що його становить лікарський засіб для навколишнього середовища);
- Ефективність (в т.ч. фармакологія, результати доклінічних та клінічних досліджень; належна клінічна практика).
При цьому Директива №2001/82/ЄС передбачає можливість подачі таких видів реєстраційних досьє:
- повне досьє (зазвичай необхідне лише для нових препаратів);
- скорочене досьє, що може застосовуватись у таких випадках: 1) при використанні заявником добре відомих субстанцій[2], 2) при використанні нової комбінації добре відомих субстанцій; 3) при реєстрації у визначеному порядку препаратів-генериків;
- гібридне досьє (комбінації повного досьє і досьє на препарат-генерик);
- досьє-копії (на основі угод між виробниками про випуск однакового продукту);
- досьє на внесення змін до раніше зареєстрованих досьє.
При цьому на відміну від українського ветеринарного законодавства Директива чітко закріплює механізм реєстрації препаратів-генериків. Так відповідно до ст.13 Директиви генерик ветеринарного лікарського засобу, зареєстрований відповідно до цього положення, розміщується на ринку, не менше ніж через десять років після першої реєстрації еталонного засобу (та 13 років у випадку ветеринарних лікарських засобів для риби або бджіл або інших видів тварин, визначених Комісією ЄС).
В цій же статті закріплено визначення поняття «генерик ветеринарного лікарського засобу», під яким розуміють лікарський засіб, який має такий же якісний та кількісний склад активнодіючих речовин та таку ж лікарську форму, що й еталонний лікарський засіб, та його біоеквівалентність з еталонним лікарським засобом доведена відповідними дослідженнями біодоступності. Солі, ефіри, складні ефіри, ізомери, суміші ізомерів, комплекси або похідні активнодіючих речовин вважаються такою самою активнодіючою речовиною, окрім випадків, коли вони значно відрізняються за властивостями, безпечністю та/або ефективністю. У таких випадках, заявник повинен надати додаткову інформацію з метою доведення безпечності та/або дієвості різних солей, складних ефірів або похідних зареєстрованої активнодіючої речовини.
Зазначені положення висвітлюють суть запровадженого в ЄС підходу до реєстрації препаратів – генериків, що передбачає, з одного боку, захист еталонного препарату на період не менше 10 років, а з іншого – спрощує порядок реєстрації препаратів – генериків після закінчення зазначеного періоду захисту.
Варто відзначити, що вимога запровадження в Україні подібного захисту щодо лікарських засобів міститься в проекті Угоди про асоціацію України з ЄС. Так, згідно зі ст. 222 Угоди «Сторони запроваджують комплексну систему, яка гарантуватиме конфіденційність, нерозкриття та незалежність даних, що надаються для цілей одержання дозволу на введення лікарського засобу на ринок. З цією метою, коли Сторона вимагає подання даних випробувань або досліджень щодо безпечності та ефективності лікарського засобу до надання дозволу на введення на ринок такого продукту, Сторона, на період не менш ніж п’ять років з дати першого дозволу в цій Стороні, не дозволятиме іншим заявникам виводити або той самий або подібний засіб, на підставі дозволу на введення на ринок, наданого заявнику, що подав дані випробувань або досліджень, якщо тільки заявник, що надав дані випробувань або досліджень не дав свою згоду. Впродовж цього періоду дані випробувань або досліджень, подані для першого дозволу, не використовуються в інтересах будь-якого наступного заявника з метою отримання дозволу на введення лікарського засобу на ринок, крім випадків, коли надано згоду першого заявника. Україна зобов’язується привести своє законодавство стосовно захисту даних для лікарських засобів із законодавством ЄС в дату, яку визначить Комітет з питань торгівлі».
Положення законодавства ЄС щодо строку дії реєстраційного посвідчення також істотно відрізняються від українського законодавства. За загальним правилом, відповідно до ст. 28 Директиви 2001/82/ЄС, як і в Україні, термін дії реєстраційного посвідчення складає п’ять років. Реєстраційне посвідчення може бути поновлене через п’ять років на основі переоцінки співвідношення ризиків та переваг. З цією метою власник реєстраційного посвідчення повинен подати зведений перелік усіх документів, поданих стосовно якості, безпечності та ефективності, в т.ч. усі зміни, внесені з моменту видачі реєстраційного посвідчення, щонайменше за шість місяців до закінчення терміну дії реєстраційного посвідчення. Однак на відміну від українського законодавства, після перереєстрації, строк дії реєстраційного посвідчення є необмеженим, крім випадків, коли уповноважений орган, на обґрунтованих підставах стосовно фармаконагляду, вирішить переглянути реєстрацію через ще один додатковий п’ятирічний термін.
Таким чином, проведений аналіз свідчить, що завдяки прийняттю відповідних директив процедура реєстрації ветпрепаратів є гармонізованою на рівні всього Європейського Союзу, а отже її основи є однаковими у всіх країнах-членах цього об’єднання. Законодавство ЄС детально регламентує можливі варіанти реєстрації ветпрепаратів, вимоги до змісту реєстраційного досьє, порядок подання та розгляду заявок на реєстрацію, порядок отримання реєстраційного посвідчення та строк його дії. В загальних рисах українська система реєстрації ветпрепаратів наближена до європейської, однак рівень правового регулювання такої реєстрації в ЄС є значно вищим. Внаслідок створення асоціації України з Євросоюзом українське законодавство, що регулює порядок реєстрації ветпрепаратів, вимагатиме гармонізації з відповідним законодавством ЄС. Така гармонізація передбачатиме ухвалення необхідних національних правових актів, що регулюють обіг ветеринарних препаратів та вдосконалення існуючих інституційних механізмів. Це матиме суттєві практичні наслідки для ветеринарної фармпромисловості, що вже зараз мають враховуватись українськими підприємцями.
[1] Замість дослівного перекладу використаного в законодавстві ЄС терміну «marketing authorization» (дозвіл на продаж) автор використовує передбачений в українському законодавстві для реєстрації ветпрепаратів термін «реєстраційне посвідчення».
[2] Такими визнаються активні (діючі) речовини, що перебували у налагодженому ветеринарному використанні в ЄС не менше 10 років, були визнані ефективними і такими, що мають прийнятний рівень безпечності.
В 2012 році після майже 5-річних переговорів було парафовано текст Угоди про асоціацію між Україною та Європейським Союзом (ЄС), включаючи положення про зону вільної торгівлі, що становлять її невід’ємну частину. Значення нової угоди для подальшого розвитку України, загалом, та її економіки, зокрема, важко переоцінити.
Як відомо, представники ЄС визначили крайнім строком для її підписання – листопад 2013 року, коли відбуватиметься саміт Східного партнерства у Вільнюсі. Завершення тривалого переговорного процесу свідчить про те, що підготовка України до асоціації з Євросоюзом переходить у практичну площину.
Розміщення в Інтернеті для загального доступу повного тексту Угоди про асоціацію [1] дозволило розпочати її вивчення та визначити основні моменти, що вливатимуть на розвиток вітчизняної ветеринарної медицини.
Набрання чинності угодою про асоціацію України з ЄС стане передумовою для комплексного реформування вітчизняного законодавства з метою його гармонізації з правом ЄС.
Зважаючи на значний інтерес українських фармацевтичних виробників та лікарів ветеринарної медицини до перспектив розвитку вітчизняного ринку ветеринарних препаратів пропонуємо Вашій увазі цикл статей, що висвітлюють основні стандарти ЄС щодо обігу ветеринарних препаратів.
Метою цієї першої статті циклу є визначення правових основ гармонізації українського законодавства, що регулює обіг ветеринарних препаратів, (надалі по тексту – ветеринарне законодавство) з правом ЄС в світлі перспективи набрання чинності угодою про асоціацію між Україною та Європейським Союзом (надалі по тексту – УА).
Як відомо, створення зони вільної торгівлі з ЄС передбачатиме скасування митних зборів та торговельних бар’єрів [2]. Запровадження національного режиму в торгівлі товарами, разом з практично повною відміною ввізних мит мають сприяти взаємному відкриттю ринків. Однак при цьому для вітчизняної фарміндустрії надзвичайно гостро постає проблема технічних бар’єрів в торгівлі, пов’язаних з взаємним визнанням технічних регламентів та стандартів виробництва продукції.
Ці питання висвітлюються Главою 3 «Технічні бар’єри в торгівлі» Розділу IV Угоди про асоціацію, що регулює питання, пов’язані з підготовкою, прийняттям та застосуванням стандартів, технічних регламентів, а також процедурами оцінки відповідності в розумінні Угоди СОТ про технічні бар’єри в торгівлі, що можуть мати вплив на торгівлю товарами між сторонами.
Зокрема, передбачається, що Україна зобов’язується вжити необхідних заходів для поступового досягнення відповідності з технічними регламентами ЄС, європейськими процедурами стандартизації, метрології, акредитації та оцінки відповідності та системою ринкового нагляду, а також впроваджувати принципи і практику, що закріплена у відповідних регламентах та директивах ЄС.
Для досягнення вказаної мети передбачається, що Україна відповідно до погодженого в Додатку ІІІ до УА графіку інкорпорує відповідне acquis ЄС[1] в законодавство України, здійснить адміністративні та інституційні реформи, необхідні для імплементації УА та Угоди про оцінку відповідності та прийнятність промислових товарів (АСАА), забезпечить функціонування необхідної для реалізації цього розділу ефективну і прозору адміністративну систему.
Додаток ІІІ до УА відображає основні здобутки технічного регулювання на рівні Євросоюзу та містить перелік відповідних актів горизонтального та секторального законодавства ЄС і графік для його імплементації Україною. Серед сфер секторальної гармонізації, перелічених в Додатку ІІІ до УА, виробництво ветеринарних препаратів відсутнє. Проте визначене в ньому горизонтальне законодавство ЄС, що має бути інкорпороване Україною, включає такі питання як загальна безпека продукції; вимоги до акредитації та нагляду за ринком, пов’язані з маркетингом продукції; загальні основи для збуту продукції. Безумовно наближення українського законодавства до зазначених правил ЄС стосуватиметься й обігу ветеринарних препаратів.
Крім цього, надзвичайно важливим для української промисловості та бізнесу є передбачене в ст. 56 УА зобов’язання України поступово перейняти корпус Європейських стандартів в національні стандарти та скасувати національні стандарти, що суперечать таким стандартам, включаючи міждержавні стандарти (ГОСТи), схвалені до 1992 року.
Таким чином, в разі підписання Угоди про асоціацію, Україна візьме на себе чіткі зобов’язання по гармонізації власного законодавства в сфері технічних регламентів, стандартів і оцінки відповідності з законодавством ЄС. Слід підкреслити, що УА передбачає механізм контролю за виконанням таких зобов’язань. На відміну від добровільних зобов’язань України по гармонізації власного законодавства, передбачених раніше в Угоді про партнерство та співробітництво, відповідні положення Угоди про асоціацію мають обов’язковий характер, а їх виконання моніторитиметься з боку Євросоюзу.
Очевидно, прийняття зазначених зобов’язань матиме наслідком необхідність реформування ветеринарного законодавства України з метою його гармонізації з правом Євросоюзу.
Як відомо, фармацевтична промисловість у Європейському Союзі працює згідно зі стандартами, що містять високі вимоги до забезпечення якості лікарських засобів при їхній розробці, виробництві та контролі. Зазначені вимоги до продукції, що потрапляє на ринок ЄС, є одними з найвищих у світі.
Варто підкреслити, що зважаючи на існування в ЄС внутрішнього ринку, що включає вільний рух товарів в межах ЄС, основи правового регламентування виробництва всіх лікарських засобів, в тому числі ветпрепаратів, є гармонізованими на рівні ЄС. Це означає, що відповідні правила визначаються на рівні інститутів та огранів ЄС, а не національних органів окремих держав-членів. Основним способом такої гармонізації законодавств держав-членів ЄС є прийняття регламентів та директив ЄС [3; 446-453].
На сучасному етапі чинне законодавство, що регулює обіг ветеринарних препаратів в ЄС зібране в Volume 5 – Pharmaceutical legislation Medicinal Products for veterinary use (Том 5 Фармацевтичне законодавство про лікарські засоби для ветеринарного застосування), що є складовою частиною загального документу The Rules Governing Medicinal Products in the European Union” (“Правила, що регулюють лікарські засоби в Європейському Союзі”) [4].
Цей том включає понад 50 нормативних актів. Серед досить об’ємного їх масиву слід окремо виділити акти, що становлять основу чинного фармацевтичного ветеринарного законодавства ЄС:
Директива Європейського Парламенту та Ради про Кодекс Співтовариства щодо лікарських засобів для ветеринарного застосування № 2001/82/ЄС від 6 листопада 2001 року (в консолідованій редакції з урахуванням всіх подальших змін до неї; останні зміни наразі внесені Директивою № 2009/53 від 18.06.2009 року);
Директива Комісії, що визначає принципи і напрямки належної практики виробництва лікарських препаратів ветеринарного призначення №91/412 від 23 липня 1991 року (Директива про GMP);
Директива Ради № 90/167/EEC від 26 березня 1990, що встановлює умови, регулюючі підготовку, розміщення на ринку і використання лікувальних кормів у Співтоваристві;
Регламент Ради, що запроваджує процедури Співтовариства щодо надання дозволів та нагляду за лікарськими засобами для використання людьми та для ветеринарних цілей та яким засновується Європейське агентство оцінки лікарських засобів N 2309/93 від 22.06.93 року;
Регламент Европарламенту та Ради про процедури ЕС щодо встановлення максимально допустимих рівнів залишкових речовин ветеринарних препаратів в харчових продуктах тваринного походження № 470/2009 від 06.05.2009 року;
Регламент Комісії про фармакологічно активні речовини та їх класифікацію щодо максимальних меж залишків у харчових продуктах тваринного походження № 37/2010 від 22 грудня 2009 року.
Основним документом, що визначає правові засади обігу ветпрепаратів ЄС є консолідована Директива № 2001/82, яка являє собою Кодекс ЄС про ветеринарні лікарські засоби. Директива є об’ємним документом, який включає 98 статей та разом з додатками складає понад 100 сторінок. Документ детально регламентує питання обігу ветеринарних препаратів в ЄС, зокрема містить основоположні визначення та регулює такі питання як: порядок реєстрації ветпрепаратів, ліцензійні умови виробництва та продажу ветпрепаратів, порядок здійснення фармаконагляду, здійснення контролю та санкції за порушення правил обігу ветпрепаратів тощо [5].
Відповідно до ст.50 (е) зазначеної директиви власник ліцензії на виробництво ветпрепаратів в ЄС повинен дотримуватись принципів та настанов належної практики (англ. Guide to Good Manufacturing Practice – GMP) для виробництва лікарських засобів та використовувати в якості вихідних матеріалів лише діючі речовини, вироблені відповідно до детальних настанов належної виробничої практики для вихідних матеріалів.
В свою чергу принципи та правила належної виробничої практики (GMP) лікарських засобів для застосування у ветеринарії визначаються Директивою 91/412/ЕЕC [6]. Докладні правила (вимоги), які узгоджуються з принципами цієї директиви, викладені в настанові з належної виробничої практики, яку використовують для оцінювання заяв на одержання ліцензій на виробництво і на підставі якої інспектують виробників лікарських засобів для ветеринарії.
Принципи GMP поширюються на всі процеси з виробництва ветпрепаратів, що потребують ліцензування. Такі процеси визначені в статті 44 Директиви 2001/82/ЕC.
Слід підкреслити, що всі держави ЄС та представники промисловості дійшли згоди, щоб вимоги належної виробничої практики щодо лікарських засобів для застосування у ветеринарії були такими самими як щодо лікарських засобів для людини [7]. Деякі більш докладні правила GMP, специфічні для виробництва лікарських засобів для ветеринарії та імунобіологічних лікарських засобів для ветеринарії, викладено у двох додатках до Директиви 2001/82 [5].
Загалом, передбачене вказаними директивами правове регулювання обігу ветпрепаратів в ЄС базується на таких принципах:
– ветеринарні препарати, дозволені для продажу на європейському ринку, виготовляються лише виробниками, що мають відповідну ліцензію на виробництво (manufacturing authorization), діяльність яких регулярно інспектується компетентними уповноваженими органами;
– кожен ветеринарний препарат, що виробляється, має бути зареєстрованим, тобто мати реєстраційне посвідчення (marketing authorization), що засвідчує проведення його експертизи у компетентному уповноваженому органі;
– якість лікарських засобів для ветеринарії забезпечується дотриманням виробником вимог належної виробничої практики (Good Manufacturing Practice – GMP);
– високий рівень якості вироблених ветеринарних препаратів підтримується в мережі дистрибуції, завдяки дотриманню постачальниками вимог належної дистрибуційної практики (Good Distribution Practice – GDP).
Подібні принципи щодо обов’язкового ліцензування діяльності з виробництва і продажу ветпрепаратів та їх обов’язкової реєстрації діють і в Україні. Однак єдині комплексні стандарти щодо належної практики виробництва і контролю якості ветеринарних препаратів та стандарти їх дистрибуції на кшталт GMP та GDP ЄС в Україні наразі відсутні. Ці питання лише частково регулюються в Законі України «Про ветеринарну медицину» та Ліцензійних умовах з виробництва та продажу ветпрепаратів.
Слід окремо підкреслити, що, з огляду на високий рівень вимог щодо якості та безпеки, чинні в ЄС стандарти виробництва та продажу ветпрепаратів визнаються не лише 27 державами-членами ЄС, а й більшістю інших країн світу. Чимало країн поступово запроваджують GMP та GDP ЄС у власне законодавство. На шлях наближення до стандартів ЄС стають і країни СНД. Так, Молдова, яка також веде переговори про асоціацію з ЄС, вже прийняла відповідний акт. Постанова уряду Республіки Молдова №93 від 15.02.2012 «Про затвердження Правил належної практики виробництва ліків ветеринарного призначення» створено базу, необхідну для застосування Директиви ЄС №91/412 [8]. Відповідні проекти розробляються і в рамках Митного союзу між Білоруссю, Росією та Казахстаном [9].
Україна в свою чергу вже має успішний досвід гармонізації законодавства про лікарські засоби для людей. На сьогодні Україна першою серед країн СНД законодавчо запровадила правила GMP та GDP як обов’язкові стосовно лікарських засобів для людей. Цьому передував тривалий (близько 10 років) підготовчий період та комплексна розробка відповідної законодавчої бази, зокрема затвердження Настанов по лікарським засобам та запровадження Ліцензійних умов виробництва та торгівлі лікарськими засобами, гармонізованих з вимогами ЄС.
Тож гармонізація ветеринарного законодавства України з правом ЄС – питання часу. Вона має забезпечити правову основу для контролю за якісним і безпечним виробництвом ветпрепаратів та дозволити вітчизняній продукції вийти на ринок Європейського Союзу та інших країн світу, що визнають стандарти ЄС.
В незалежності від строків підписання Угоди про асоціацію, для української ветеринарної фармпромисловості гармонізація ветеринарного законодавства є нагальною необхідністю, що обумовлена вимогами ринкової економіки: ЄС допускає на власний внутрішній ринок лише ветеринарні препарати, вироблені відповідно до стандартів якості, адекватних його стандартам, зокрема GMP.
Перспектива укладання Угоди про асоціацію, а також економічні реалії та необхідність зміцнення експортного потенціалу вітчизняної ветеринарної фарміндустрії зумовлює нагальну потребу у визначенні державної політики щодо реформування української ветеринарної фармацевтичної промисловості та прийнятті плану заходів з розробки нормативно-правових актів в сфері обігу ветеринарних препаратів, гармонізованих з законодавством ЄС. Комплексна гармонізація ветеринарного законодавства України з правом ЄС потребує зваженої політики компетентних органів державної влади й урахування інтересів українських виробників. Метою такої гармонізації має бути створення належних умов для забезпечення якості і безпечності ветеринарних препаратів, що знаходяться на українському ринку.
[1] Французьке слово «acquis» [вимовляється: акі] буквально перекладається як надбання,здобуток, доробок, спадщина. В праві ЄС під терміном acquis ЄС прийнято розуміти всю сукупність положень установчих договорів ЄС та прийнятих/укладених Союзом на їх основі законодавчих актів і міжнародних угод, а також практику застосування і тлумачення цього нормативного масиву, насамперед практику Суду ЄС.
Скрипник В.Г., доктор ветеринарних наук
Березовська І.А., кандидат юридичних наук
Паскевич К.І.. директор з розвитку
Українська Асоціація виробників та дистриб’юторів ветеринарних препаратів та кормових добавок (Ветпромспілка)
На грудневому засіданні Ради директорів Української Асоціації виробників та дистриб’юторів ветеринарних препаратів та кормових добавок було окреслено коло першочергових завдань. До переліку таких питань ввійшли і реформування нормативно-законодавчої бази, підвищення якості продукції, активна боротьба з контрафактною та фальсифікованою продукцією на ринку України.
За роки незалежності галузь виробництва ветеринарних препаратів пройшла значний шлях свого розвитку. І якщо недержавна ланка галузі зі скрипом та значними потугами розвивалася, то державна частка галузі «повільно але впевнено» скорочувала своє виробництво. Ще 5-10 років тому вітчизняне промислове виробництво ветеринарних препаратів було повністю в тіні більш фінансово потужних закордонних компаній. Сьогодні ж члени Асоціації виготовляють 50% вітчизняних імунобіологічних і 65% хіміко-фармацевтичних препаратів. Із них більше 150 найменувань експортують у 15 країн світу. Це вагомий вклад у забезпечення протиепізоотичного благополуччя країни, забезпечення здоров’я тварин та незалежності від імпорту ветеринарних препаратів і кормових добавок.
Рада директорів Української асоціації виробників і дистриб’юторів ветеринарних препаратів і кормових добавок («Ветпромспілка») прийняла рішення щодо використання логотипу Асоціації на продукції гарантовано високої якості, яка виготовляється членами Асоціації.
Логотип буде доповнено написом: «Рекомендовано Українською асоціацією виробників і дистриб’юторів ветеринарних препаратів та кормових добавок» і матиме такий вигляд:
«Рекомендовано українською асоціацією виробників і дистриб’юторів ветеринарних препаратів та кормових добавок»
Логотип Асоціації з написом буде друкуватись на етикетках та коробках продукції, а також буде використовуватись у рекламних матеріалах незалежно від носіїв реклами.
Продукт, що маркуватиметься даним логотипом та написом, як мінімум повинен відповідати наступним вимогам:
- Мати період використання на ринку України не менше 2 років без рекламацій та скарг на якість та/або експортування препарату за кордон.
- Умови його зберігання та транспортування відповідають чинним вимогам законодавства.
- Мати свідоцтво про реєстрацію препарату в Україні.
- Бути виготовленим, згідно стандартів ISO-9001 або GMP або HACCP.
- Виробник має ліцензію на виробництво даного виду продукції.
Заява на присвоєння такого знаку по кожному препарату подається до Ради директорів Асоціації, де розглядається протягом 10 робочих днів. Після цього Заявнику надається письмовий висновок про можливість або неможливість використання логотипу Асоціації з відповідним написом для застосування при маркуванні заявленої продукції та використання у рекламних матеріалах даного препарату.
Підписання документів про асоціацію України з ЄС дає нові можливості для розвитку галузі як для задоволення потреб внутрішнього ринку, так і для реалізації власного експортного потенціалу.
На жаль існує ціла низка проблем, які перешкоджають розвитку галузі та не дозволяють сьогодні повноцінно співпрацювати з закордонними країнами. Серед нагальних проблем, що сьогодні постали перед галуззю, можна виділити найболючіші:
- Проблеми внутрішнього законодавства та його невідповідність законодавству ЄС;
- Відсутність вектору підтримки вітчизняного виробника ветеринарних препаратів у внутрішній та зовнішній політиці державних органів влади;
- Необхідність залучення значних інвестицій задля модернізації більшої частини виробництва у відповідності до вимог сучасних стандартів якості та організації робіт.
Невідповідність українського та європейського законодавства практично унеможливлює збільшення експорту нашої продукції в країни не тільки Європи, але й Африки, Азії та інші. У більшості розвинутих країн світу (навіть у наших сусідів – Росії, Молдові) визнано необхідність проведення сертифікації виробництва у відповідності зі широковживаними стандартами GMP. На жаль, в нашій країні ці стандарти для виробництва ветеринарних препаратів не розроблені; орган, який би проводив сертифікацію та контролював поточне виконання та розвиток стандартів не створений.
З огляду на те, що «доля потопаючих в їх власних руках», координацію роботи щодо доопрацювання законодавства повинна взяти на себе Асоціація в тісному співробітництві з Державною ветеринарною та фітосанітарною службою під патронатом Міністерства аграрної політики.
Основні напрямки гармонізації законодавства
України з законодавством Європейського Союзу щодо
обігу ветеринарних препаратів (ВП)
| №з/п | Визначення напрямку гармонізації | Чинне ветеринарне з-во України | Примітки та пропозиції |
| 1 | Загальне визнання на рівні нормативних актів необхідності комплексної гармонізації законодавства України щодо обігу ВП з правом ЄС та визначення плану такої гармонізації | Окремий законодавчий акт, що регулював би обіг ВП (на зразок Кодексу ЕС про ветеринарні препарати чи ЗУ «Про лікарські засоби») наразі в Україні відсутній
Певні аспекти обігу ВП в загальних рисах регулюються Законом України «Про ветеринарну медицину» (Розділ 10, 11, ст.63-78). Ліцензійні умови з виробництва ВП та оптової/роздрібної торгівлі ВП дуже стисло регулюють основні аспекти обігу ВП. 14.05.2014 року – Держветфітосанітарною службою було затверджено МЕТОДИЧНІ РЕКОМЕНДАЦІЇ щодо основних правил належної практики виробництва та контролю якості ветеринарних препаратів
|
Законодавство України про обіг ВП потребує комплексного аналізу і реформування з метою поступової гармонізації з законодавством та стандартами ЄС. Запровадження в Україні законодавства максимально наближеного до законодавства ЄС шляхом імплементації положень відповідних директив ЄС та визнання його відповідності дозволить українським виробникам відкрити нові ринки збуту, оскільки більшість країн світу визнає стандарти ЄС щодо обігу ВП достатніми для допуску таких препаратів на свої ринки.
Гармонізація законодавства з правом ЄС має включати такі напрямки: 1) Чітке законодавче визначення основних понять в сфері обігу ВП по аналогії з підходом ЄС; 2) Гармонізація Ліцензійних умов та поступовий перехід до обов’язкового дотримання належної виробничої практики для ветеринарних препаратів (GMP) 3) Гармонізація порядку реєстрації ВП 4) Визначення компетентного національного центру з підтвердження відповідності вітчизняних виробників вимогам GMP для ветеринарних препаратів та організація вступу Державної ветеринарної і фітосанітарної служби (чи іншого органу) до міжнародної системи співробітництва фармацевтичних інспекцій (PIC/S). 5) Гармонізація умов належної дистрибуції 6) Створення дієвих механізмів боротьби з наявністю на ринку незареєстрованих, фальсифікованих ВП. Аналіз по напрямкам див. нижче З урахуванням вищесказаного потрібно затвердити конкретний план гармонізації законодавства України щодо обігу ВП з законодавством ЄС. Цілком доцільною може стати й розробка окремого законопроекту «Про ветеринарні препарати» чи «Про ветеринарні лікарські засоби», який би став спеціалізованим актом і запровадив гармонізовані напрямки регулювання |
| 1.1 | Чітке законодавче визначення основних термінів (понять) в сфері обігу ВП по аналогії з підходом ЄС
|
Частина понять визначена в ЗУ «Про ветеринарні препарати» (зокрема, ВП, ветеринарні лікарські засоби, субстанція), однак є істотні відмінності з поняттями визначеними в праві ЄС. Ряд понять (зокрема, генерики, гомеопатичний засіб) відсутні. | Коректне визначення термінів допоможе забезпечити ідентичний підхід вимог до реєстрації та виробництва конкретних видів ВП. |
| 2 | Гармонізація Ліцензійних умов та поступовий перехід до обов’язкового дотримання належної виробничої практики для ветеринарних препаратів (GMP) | Див. нижче підпункти 2.1 -2.4 | |
| 2.1. | Законодавче закріплення поняття та необхідності Належної виробничої практики (GMP) для ВП
|
Протягом тривалого часу у законодавстві України було відсутнє посилання на GMP ЄС.
Ст. 66 ЗУ «Про ветеринарну медицину» «3.Під час виробництва ветеринарних препаратів особи повинні дотримуватися вимог належної практики виробництва та інших вимог, визначених Департаментом». Прийняті 14.05.2014 року – Держветфітосанітарною службою МЕТОДИЧНІ РЕКОМЕНДАЦІЇ щодо основних правил належної практики виробництва та контролю якості ветеринарних препаратів базуються на відповідній директиві ЄС та в майбутньому мають стати основою для ліцензійних умов. |
Наказом Департаменту потрібно дати визначення належної виробничої практики та визнати її необхідність (добровільної – на перехідний період, та обов’язкової в перспективі) |
| 2.2 | Введення в дію стандартів належної виробничої практики (GMP) для ВП
|
Наразі дуже стислі обов’язкові вимоги передбачені в Ліцензійних умовах з виробництва ВП з таких аспектів як:
-організаційні вимоги; – вимоги до виробничих зон; -вимоги до складських зон; -вимоги до контролю якості; – вимоги до допоміжних зон; – спеціальні вимоги до стерильності виробництва |
Має бути затверджена відповідна Настанова з Належної виробничої практики щодо ветеринарних препаратів (в т .ч. ветеринарна специфіка, викладена в додатках 4, 5). |
| 2.3 | Гармонізація вимог до отримання ліцензії на виробництво ВП | Ліцензійні умови на виробництво ВП
Підставою для видачі ліцензії на виробництво є наявність відповідної матеріально-технічної бази, кваліфікованого персоналу, а також умов для контролю якості ветеринарних препаратів, що вироблятимуться |
Після прийняття Настанови з належної виробничої практики для ВП (GMP) необхідно внести зміни до Ліцензійних умов на виробництво, в яких передбачити:
1.Необхідність обов’язкового інспектування виробника перед видачею ліцензії (п.1.11 ЛУ МОЗ); 2. Видачу ліцензії на виробництво з урахуванням переліку лікарських форм та особливих умов провадження господарської діяльності, які зазначаються в окремих додатках до 3. Необхідність отримання реєстраційного посвідчення «marketing authorization» на ВП за гармонізованою процедурою 4. Наявність у штаті Виробника принаймні однієї Уповноваженої особи, що підтверджує проведення перевірки вироблених ВП на відповідність РП ( ст.52 Директиви ЄС № 2001/82/ п.2.4. Національної Настанови з GMP); 5.Наявність в структурі незалежного відділу контролю якості; 6.Забезпечення можливості вилучення неякісних препаратів з обігу (п.2.9 ЛУ МОЗ); 7.Необхідність отримання виробником ліцензії на оптову торгівлю; тощо |
| 2.4. | Необхідність GMP для імпортованих ВП | Подібна вимога відсутня | Введення обов’язковості GMP в Україні передбачатиме такі ж вимоги й до імпортних ВП |
| 3 | Гармонізація порядку реєстрації ВП | Постанова Кабінету Міністрів України “Про затвердження Положення про державну реєстрацію ветеринарних препаратів» N 1349 від 21.11. 2007;
Наказ Державного комітету ветеринарної медицини України 14.07.2008 N 133. |
Процедура реєстрації ВП має бути докорінно реформована відповідно до вимог ЄС – Директива ЄС № 2001/82/ЄС від 6.11.2001, Додаток №1,;
Робота з підготовки змін до зазначеного наказу розпочата в рамках Робочої групи |
| 4 | Визначення компетентного національного центру з підтвердження відповідності вітчизняних виробників вимогам GMP для ветеринарних препаратів та організація вступу Державної ветеринарної і фітосанітарної служби (чи іншого органу) до міжнародної системи співробітництва фармацевтичних інспекцій (PIC/S).
|
Відповідно до ЗУ «Про ветеринарну медицину», наразі видачу ліцензій здійснює Дерветфітосанітарна служба, вона ж видає реєстраційні посвідчення.
Деякі контрольні фінкції виконують контрольні інститути. Питання підтвердження відповідності не вирішене. |
Потрібне визначення компетентного органу, що здійснюватиме експертизу і підтвердження відповідності умов виробництва ВП та видаватиме підтверджувальні документи.
Окремими проблемним питанням є підготовка експертів та включення такого органу до міжнародної системи співробітництва фармацевтичних інспекцій (PIC/S) чи альтернативне вирішення питання визнання документів. Що видаються. |
| 5. | Гармонізація вимог до отримання ліцензії на оптову торгівлю ВП | Ліцензійні умови на торгівлю ВП
|
Після прийняття Настанови з належної дистриб’юторської практики GDP для ВП необхідно внести зміни до Ліцензійних умов на оптову торгівлю, в яких передбачити:
1.Необхідність дотримання GDP; 2.Необхідність обов’язкового інспектування дистриб’ютора перед видачею ліцензії; 3. Закріплення можливості закупівель і продажів ВП лише суб’єктами, що мають ліцензію на торгівлю; 4. Наявність у штаті Уповноваженої особи; 5.Наявність плану дій щодо вилучення з обігу неякісних ветпрепаратів за розпорядженням компетентних органів; 6.Обов’язок зберігання документації по продажам протягом 5 –ти років; і т.д. |
| 6 | Створення дієвих механізмів боротьби з наявністю на ринку незареєстрованих, фальсифікованих ВП.
|
ЗУ «Про ліцензування певних видів господарської діяльності» (складна процедура позбавлення ліцензії)
Наказ Держдепартаменту ветмедицини № 39 від 28.05.2003, про Про затвердження Положення про проведення державного контролю та нагляду за якістю ветеринарних препаратів, субстанцій, готових кормів, кормових добавок та засобів ветеринарної медицини, які застосовуються в Україні” Існуючі механізми протидії незаконному обігу ветпрепаратів на практиці малоефективні |
Питання потребує окремої розробки. |
Зрозуміло, що прийняття нових стандартів і законів змусить перебудовуватися і виробника. Але від цього лише виграють споживачі! Безумовно перехід до нових стандартів повинен бути прописаний у часі, щоб дати можливість модернізуватися всім охочим. Але починати треба вже сьогодні – 2018 рік не за горами, і без гармонізованого на той час законодавства галузь може зникнути. Перегляд законодавства обов’язково повинен бути зроблений з урахуванням вектору на підтримку вітчизняного виробника. На жаль, у нас сьогодні, наприклад, відсутній паритет у відношенні до власного та іноземного виробника при реєстрації продукції. Необхідність атестації виробництва та відділів контролю якості, процедури випробування препаратів de facto, вимога про депонування штамів мікроорганізмів – є вимогами, що стосуються тільки вітчизняних компаній. Крім того, порядок зберігання досьє на препарати та комерціалізованість самих контрольних інститутів, призводить до порушення комерційної таємниці та прав інтелектуальної власності. Більш часта перереєстрація препаратів, у порівнянні з нормами ЄС, призводить лише до збільшення затрат виробника і не є дієвим механізмом контролю за якістю препаратів. Загалом, функції контрольних інститутів повинні бути переглянуті і оптимізовані до сучасних умов.
Частина дозволів, таких як дозвіл на експорт та екологічна декларація, повинні бути відмінені. Необхідно вирішити колізію з зареєстрованими в минулому промисловими зразками, що в дійсності не є власне розробленими і запатентованими, і наявність чого може призвести до майбутніх проблем і втрат. Крім того, необхідно посилити роботу по боротьбі з контрафактною та контрабандною продукцією, підвищити відповідальність за ці дії, включно до кримінальної. Більше уваги необхідно приділити прозорості роботи контрольних інститутів, громадському контролю їх діяльності; наповнити новим змістом роботу Громадської ради при ДВСФУ.
На жаль, сьогодні підтримка власного виробника відсутня навіть там, де вона апріорі повинна бути – на зовнішніх ринках. І тут, мабуть, теж повинна докласти зусиль Асоціація, щоб і МінАПП, і ДВФСУ, і МЗС, і торгово-промислова палата у своїх заходах за кордоном доносили до можливих партнерів гасло про високу якість нашої продукції та великий потенціал нашої галузі.
Самі ж виробники повинні сконцентруватися на залученні інвестицій та розвитку власних виробництв. Хоча сьогодні якість препаратів і задовольняє споживачів, та ринок препаратів не стоїть на місці. Потрібні інвестиції, насамперед, в розвиток технологій та розробку сучасних препаратів, модернізацію існуючого виробництва для досягнення відповідності стандартів GMP, HACCP, в підготовку наукових кадрів світового рівня.
Але якби не було складно, перший досвід такої співпраці вже є. За підтримки ДВФСУ та участі Ветпромспілки перший вітчизняний виробник імунобіологічних препаратів успішно пройшов інспектування виробництва вакцин на відповідність вимогам GMP. І хоча сьогодні компанія офіційно не має атестату GMP , основні вимоги до якості препаратів відповідають цьому стандарту, що і підтвердила інспекція, а НВП БіоТестЛаб отримало дозвіл на реєстрацію вітчизняних вакцин у країнах Африки. І компанія НВП БіоТестЛаб, і Ветпромспілка щиро вдячні ДВФСУ і, окремо, заступнику Голови ДВФСУ В.В. Башинському та Директору Департаменту ветеринарної медицини О.М. Вержиховському за високу оцінку продукції компанії та підтримку при проведенні інспекції.
Скрипник В.Г., доктор ветеринарних наук
Березовська І.А., кандидат юридичних наук
Паскевич К.І.. директор з розвитку
Українська Асоціація виробників та дистриб’юторів ветеринарних препаратів та кормових добавок (Ветпромспілка)
На грудневому засіданні Ради директорів Української Асоціації виробників та дистриб’юторів ветеринарних препаратів та кормових добавок було окреслено коло першочергових завдань. До переліку таких питань ввійшли і реформування нормативно-законодавчої бази, підвищення якості продукції, активна боротьба з контрафактною та фальсифікованою продукцією на ринку України.
За роки незалежності галузь виробництва ветеринарних препаратів пройшла значний шлях свого розвитку. І якщо недержавна ланка галузі зі скрипом та значними потугами розвивалася, то державна частка галузі «повільно але впевнено» скорочувала своє виробництво. Ще 5-10 років тому вітчизняне промислове виробництво ветеринарних препаратів було повністю в тіні більш фінансово потужних закордонних компаній. Сьогодні ж члени Асоціації виготовляють 50% вітчизняних імунобіологічних і 65% хіміко-фармацевтичних препаратів. Із них більше 150 найменувань експортують у 15 країн світу. Це вагомий вклад у забезпечення протиепізоотичного благополуччя країни, забезпечення здоров’я тварин та незалежності від імпорту ветеринарних препаратів і кормових добавок.
Рада директорів Української асоціації виробників і дистриб’юторів ветеринарних препаратів і кормових добавок («Ветпромспілка») прийняла рішення щодо використання логотипу Асоціації на продукції гарантовано високої якості, яка виготовляється членами Асоціації.
Логотип буде доповнено написом: «Рекомендовано Українською асоціацією виробників і дистриб’юторів ветеринарних препаратів та кормових добавок» і матиме такий вигляд:
«Рекомендовано українською асоціацією виробників і дистриб’юторів ветеринарних препаратів та кормових добавок»
Логотип Асоціації з написом буде друкуватись на етикетках та коробках продукції, а також буде використовуватись у рекламних матеріалах незалежно від носіїв реклами.
Продукт, що маркуватиметься даним логотипом та написом, як мінімум повинен відповідати наступним вимогам:
- Мати період використання на ринку України не менше 2 років без рекламацій та скарг на якість та/або експортування препарату за кордон.
- Умови його зберігання та транспортування відповідають чинним вимогам законодавства.
- Мати свідоцтво про реєстрацію препарату в Україні.
- Бути виготовленим, згідно стандартів ISO-9001 або GMP або HACCP.
- Виробник має ліцензію на виробництво даного виду продукції.
Заява на присвоєння такого знаку по кожному препарату подається до Ради директорів Асоціації, де розглядається протягом 10 робочих днів. Після цього Заявнику надається письмовий висновок про можливість або неможливість використання логотипу Асоціації з відповідним написом для застосування при маркуванні заявленої продукції та використання у рекламних матеріалах даного препарату.
Підписання документів про асоціацію України з ЄС дає нові можливості для розвитку галузі як для задоволення потреб внутрішнього ринку, так і для реалізації власного експортного потенціалу.
На жаль існує ціла низка проблем, які перешкоджають розвитку галузі та не дозволяють сьогодні повноцінно співпрацювати з закордонними країнами. Серед нагальних проблем, що сьогодні постали перед галуззю, можна виділити найболючіші:
- Проблеми внутрішнього законодавства та його невідповідність законодавству ЄС;
- Відсутність вектору підтримки вітчизняного виробника ветеринарних препаратів у внутрішній та зовнішній політиці державних органів влади;
- Необхідність залучення значних інвестицій задля модернізації більшої частини виробництва у відповідності до вимог сучасних стандартів якості та організації робіт.
Невідповідність українського та європейського законодавства практично унеможливлює збільшення експорту нашої продукції в країни не тільки Європи, але й Африки, Азії та інші. У більшості розвинутих країн світу (навіть у наших сусідів – Росії, Молдові) визнано необхідність проведення сертифікації виробництва у відповідності зі широковживаними стандартами GMP. На жаль, в нашій країні ці стандарти для виробництва ветеринарних препаратів не розроблені; орган, який би проводив сертифікацію та контролював поточне виконання та розвиток стандартів не створений.
З огляду на те, що «доля потопаючих в їх власних руках», координацію роботи щодо доопрацювання законодавства повинна взяти на себе Асоціація в тісному співробітництві з Державною ветеринарною та фітосанітарною службою під патронатом Міністерства аграрної політики.
Основні напрямки гармонізації законодавства
України з законодавством Європейського Союзу щодо
обігу ветеринарних препаратів (ВП)
| №з/п | Визначення напрямку гармонізації | Чинне ветеринарне з-во України | Примітки та пропозиції |
| 1 | Загальне визнання на рівні нормативних актів необхідності комплексної гармонізації законодавства України щодо обігу ВП з правом ЄС та визначення плану такої гармонізації | Окремий законодавчий акт, що регулював би обіг ВП (на зразок Кодексу ЕС про ветеринарні препарати чи ЗУ «Про лікарські засоби») наразі в Україні відсутній
Певні аспекти обігу ВП в загальних рисах регулюються Законом України «Про ветеринарну медицину» (Розділ 10, 11, ст.63-78). Ліцензійні умови з виробництва ВП та оптової/роздрібної торгівлі ВП дуже стисло регулюють основні аспекти обігу ВП. 14.05.2014 року – Держветфітосанітарною службою було затверджено МЕТОДИЧНІ РЕКОМЕНДАЦІЇ щодо основних правил належної практики виробництва та контролю якості ветеринарних препаратів
|
Законодавство України про обіг ВП потребує комплексного аналізу і реформування з метою поступової гармонізації з законодавством та стандартами ЄС. Запровадження в Україні законодавства максимально наближеного до законодавства ЄС шляхом імплементації положень відповідних директив ЄС та визнання його відповідності дозволить українським виробникам відкрити нові ринки збуту, оскільки більшість країн світу визнає стандарти ЄС щодо обігу ВП достатніми для допуску таких препаратів на свої ринки.
Гармонізація законодавства з правом ЄС має включати такі напрямки: 1) Чітке законодавче визначення основних понять в сфері обігу ВП по аналогії з підходом ЄС; 2) Гармонізація Ліцензійних умов та поступовий перехід до обов’язкового дотримання належної виробничої практики для ветеринарних препаратів (GMP) 3) Гармонізація порядку реєстрації ВП 4) Визначення компетентного національного центру з підтвердження відповідності вітчизняних виробників вимогам GMP для ветеринарних препаратів та організація вступу Державної ветеринарної і фітосанітарної служби (чи іншого органу) до міжнародної системи співробітництва фармацевтичних інспекцій (PIC/S). 5) Гармонізація умов належної дистрибуції 6) Створення дієвих механізмів боротьби з наявністю на ринку незареєстрованих, фальсифікованих ВП. Аналіз по напрямкам див. нижче З урахуванням вищесказаного потрібно затвердити конкретний план гармонізації законодавства України щодо обігу ВП з законодавством ЄС. Цілком доцільною може стати й розробка окремого законопроекту «Про ветеринарні препарати» чи «Про ветеринарні лікарські засоби», який би став спеціалізованим актом і запровадив гармонізовані напрямки регулювання |
| 1.1 | Чітке законодавче визначення основних термінів (понять) в сфері обігу ВП по аналогії з підходом ЄС
|
Частина понять визначена в ЗУ «Про ветеринарні препарати» (зокрема, ВП, ветеринарні лікарські засоби, субстанція), однак є істотні відмінності з поняттями визначеними в праві ЄС. Ряд понять (зокрема, генерики, гомеопатичний засіб) відсутні. | Коректне визначення термінів допоможе забезпечити ідентичний підхід вимог до реєстрації та виробництва конкретних видів ВП. |
| 2 | Гармонізація Ліцензійних умов та поступовий перехід до обов’язкового дотримання належної виробничої практики для ветеринарних препаратів (GMP) | Див. нижче підпункти 2.1 -2.4 | |
| 2.1. | Законодавче закріплення поняття та необхідності Належної виробничої практики (GMP) для ВП
|
Протягом тривалого часу у законодавстві України було відсутнє посилання на GMP ЄС.
Ст. 66 ЗУ «Про ветеринарну медицину» «3.Під час виробництва ветеринарних препаратів особи повинні дотримуватися вимог належної практики виробництва та інших вимог, визначених Департаментом». Прийняті 14.05.2014 року – Держветфітосанітарною службою МЕТОДИЧНІ РЕКОМЕНДАЦІЇ щодо основних правил належної практики виробництва та контролю якості ветеринарних препаратів базуються на відповідній директиві ЄС та в майбутньому мають стати основою для ліцензійних умов. |
Наказом Департаменту потрібно дати визначення належної виробничої практики та визнати її необхідність (добровільної – на перехідний період, та обов’язкової в перспективі) |
| 2.2 | Введення в дію стандартів належної виробничої практики (GMP) для ВП
|
Наразі дуже стислі обов’язкові вимоги передбачені в Ліцензійних умовах з виробництва ВП з таких аспектів як:
-організаційні вимоги; – вимоги до виробничих зон; -вимоги до складських зон; -вимоги до контролю якості; – вимоги до допоміжних зон; – спеціальні вимоги до стерильності виробництва |
Має бути затверджена відповідна Настанова з Належної виробничої практики щодо ветеринарних препаратів (в т .ч. ветеринарна специфіка, викладена в додатках 4, 5). |
| 2.3 | Гармонізація вимог до отримання ліцензії на виробництво ВП | Ліцензійні умови на виробництво ВП
Підставою для видачі ліцензії на виробництво є наявність відповідної матеріально-технічної бази, кваліфікованого персоналу, а також умов для контролю якості ветеринарних препаратів, що вироблятимуться |
Після прийняття Настанови з належної виробничої практики для ВП (GMP) необхідно внести зміни до Ліцензійних умов на виробництво, в яких передбачити:
1.Необхідність обов’язкового інспектування виробника перед видачею ліцензії (п.1.11 ЛУ МОЗ); 2. Видачу ліцензії на виробництво з урахуванням переліку лікарських форм та особливих умов провадження господарської діяльності, які зазначаються в окремих додатках до 3. Необхідність отримання реєстраційного посвідчення «marketing authorization» на ВП за гармонізованою процедурою 4. Наявність у штаті Виробника принаймні однієї Уповноваженої особи, що підтверджує проведення перевірки вироблених ВП на відповідність РП ( ст.52 Директиви ЄС № 2001/82/ п.2.4. Національної Настанови з GMP); 5.Наявність в структурі незалежного відділу контролю якості; 6.Забезпечення можливості вилучення неякісних препаратів з обігу (п.2.9 ЛУ МОЗ); 7.Необхідність отримання виробником ліцензії на оптову торгівлю; тощо |
| 2.4. | Необхідність GMP для імпортованих ВП | Подібна вимога відсутня | Введення обов’язковості GMP в Україні передбачатиме такі ж вимоги й до імпортних ВП |
| 3 | Гармонізація порядку реєстрації ВП | Постанова Кабінету Міністрів України “Про затвердження Положення про державну реєстрацію ветеринарних препаратів» N 1349 від 21.11. 2007;
Наказ Державного комітету ветеринарної медицини України 14.07.2008 N 133. |
Процедура реєстрації ВП має бути докорінно реформована відповідно до вимог ЄС – Директива ЄС № 2001/82/ЄС від 6.11.2001, Додаток №1,;
Робота з підготовки змін до зазначеного наказу розпочата в рамках Робочої групи |
| 4 | Визначення компетентного національного центру з підтвердження відповідності вітчизняних виробників вимогам GMP для ветеринарних препаратів та організація вступу Державної ветеринарної і фітосанітарної служби (чи іншого органу) до міжнародної системи співробітництва фармацевтичних інспекцій (PIC/S).
|
Відповідно до ЗУ «Про ветеринарну медицину», наразі видачу ліцензій здійснює Дерветфітосанітарна служба, вона ж видає реєстраційні посвідчення.
Деякі контрольні фінкції виконують контрольні інститути. Питання підтвердження відповідності не вирішене. |
Потрібне визначення компетентного органу, що здійснюватиме експертизу і підтвердження відповідності умов виробництва ВП та видаватиме підтверджувальні документи.
Окремими проблемним питанням є підготовка експертів та включення такого органу до міжнародної системи співробітництва фармацевтичних інспекцій (PIC/S) чи альтернативне вирішення питання визнання документів. Що видаються. |
| 5. | Гармонізація вимог до отримання ліцензії на оптову торгівлю ВП | Ліцензійні умови на торгівлю ВП
|
Після прийняття Настанови з належної дистриб’юторської практики GDP для ВП необхідно внести зміни до Ліцензійних умов на оптову торгівлю, в яких передбачити:
1.Необхідність дотримання GDP; 2.Необхідність обов’язкового інспектування дистриб’ютора перед видачею ліцензії; 3. Закріплення можливості закупівель і продажів ВП лише суб’єктами, що мають ліцензію на торгівлю; 4. Наявність у штаті Уповноваженої особи; 5.Наявність плану дій щодо вилучення з обігу неякісних ветпрепаратів за розпорядженням компетентних органів; 6.Обов’язок зберігання документації по продажам протягом 5 –ти років; і т.д. |
| 6 | Створення дієвих механізмів боротьби з наявністю на ринку незареєстрованих, фальсифікованих ВП.
|
ЗУ «Про ліцензування певних видів господарської діяльності» (складна процедура позбавлення ліцензії)
Наказ Держдепартаменту ветмедицини № 39 від 28.05.2003, про Про затвердження Положення про проведення державного контролю та нагляду за якістю ветеринарних препаратів, субстанцій, готових кормів, кормових добавок та засобів ветеринарної медицини, які застосовуються в Україні” Існуючі механізми протидії незаконному обігу ветпрепаратів на практиці малоефективні |
Питання потребує окремої розробки. |
Зрозуміло, що прийняття нових стандартів і законів змусить перебудовуватися і виробника. Але від цього лише виграють споживачі! Безумовно перехід до нових стандартів повинен бути прописаний у часі, щоб дати можливість модернізуватися всім охочим. Але починати треба вже сьогодні – 2018 рік не за горами, і без гармонізованого на той час законодавства галузь може зникнути. Перегляд законодавства обов’язково повинен бути зроблений з урахуванням вектору на підтримку вітчизняного виробника. На жаль, у нас сьогодні, наприклад, відсутній паритет у відношенні до власного та іноземного виробника при реєстрації продукції. Необхідність атестації виробництва та відділів контролю якості, процедури випробування препаратів de facto, вимога про депонування штамів мікроорганізмів – є вимогами, що стосуються тільки вітчизняних компаній. Крім того, порядок зберігання досьє на препарати та комерціалізованість самих контрольних інститутів, призводить до порушення комерційної таємниці та прав інтелектуальної власності. Більш часта перереєстрація препаратів, у порівнянні з нормами ЄС, призводить лише до збільшення затрат виробника і не є дієвим механізмом контролю за якістю препаратів. Загалом, функції контрольних інститутів повинні бути переглянуті і оптимізовані до сучасних умов.
Частина дозволів, таких як дозвіл на експорт та екологічна декларація, повинні бути відмінені. Необхідно вирішити колізію з зареєстрованими в минулому промисловими зразками, що в дійсності не є власне розробленими і запатентованими, і наявність чого може призвести до майбутніх проблем і втрат. Крім того, необхідно посилити роботу по боротьбі з контрафактною та контрабандною продукцією, підвищити відповідальність за ці дії, включно до кримінальної. Більше уваги необхідно приділити прозорості роботи контрольних інститутів, громадському контролю їх діяльності; наповнити новим змістом роботу Громадської ради при ДВСФУ.
На жаль, сьогодні підтримка власного виробника відсутня навіть там, де вона апріорі повинна бути – на зовнішніх ринках. І тут, мабуть, теж повинна докласти зусиль Асоціація, щоб і МінАПП, і ДВФСУ, і МЗС, і торгово-промислова палата у своїх заходах за кордоном доносили до можливих партнерів гасло про високу якість нашої продукції та великий потенціал нашої галузі.
Самі ж виробники повинні сконцентруватися на залученні інвестицій та розвитку власних виробництв. Хоча сьогодні якість препаратів і задовольняє споживачів, та ринок препаратів не стоїть на місці. Потрібні інвестиції, насамперед, в розвиток технологій та розробку сучасних препаратів, модернізацію існуючого виробництва для досягнення відповідності стандартів GMP, HACCP, в підготовку наукових кадрів світового рівня.
Але якби не було складно, перший досвід такої співпраці вже є. За підтримки ДВФСУ та участі Ветпромспілки перший вітчизняний виробник імунобіологічних препаратів успішно пройшов інспектування виробництва вакцин на відповідність вимогам GMP. І хоча сьогодні компанія офіційно не має атестату GMP , основні вимоги до якості препаратів відповідають цьому стандарту, що і підтвердила інспекція, а НВП БіоТестЛаб отримало дозвіл на реєстрацію вітчизняних вакцин у країнах Африки. І компанія НВП БіоТестЛаб, і Ветпромспілка щиро вдячні ДВФСУ і, окремо, заступнику Голови ДВФСУ В.В. Башинському та Директору Департаменту ветеринарної медицини О.М. Вержиховському за високу оцінку продукції компанії та підтримку при проведенні інспекції.
Що заважає розвитку індустрії ветеринарних препаратів.
Скрипник В.Г., генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок.
Лісовенко В.Т., голова Ради директорів Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок.
Вже давно є аксіомою той факт, що без якісних (ефективних і безпечних) ветеринарних препаратів неможливий розвиток промислового тваринництва. В Україні після розпаду СРСР народилася, зміцніла і нарощує обсяги виробництва вітчизняна індустрія виробництва ветеринарних препаратів різних форм власності. Вітчизняні препарати успішно конкурують із закордонними аналогами на ринку України та за її межами, поступово завойовуючи ринки інших держав. Але подальший розвиток виробництва гальмується низкою об’єктивних і суб’єктивних факторів. Розглянемо основні з них.
- Очевидно, що без розвитку тваринництва в державі, нарощування обсягів виробництва ветеринарних препаратів сповільнюється. А ми можемо констатувати, що кількість поголів’я тварин у державі неухильно зменшується. Тому виробники змушені завойовувати зовнішні ринки, а це справа не проста і не швидка, хоча і має свої плюси у вигляді підвищення якості продукції, що тягне за собою покращення стандартів виробництва.
- Загальнодержавний занепад фінансової системи, неможливість доступу до кредитних ліній не дає змоги швидко і ефективно проводити модернізацію виробництва і підвищувати стандарти якості продукції.
- Стагнація вітчизняної науки взагалі і ветеринарної зокрема. Наука перестала генерувати нові ідеї, розробляти нові ефективні ветеринарні препарати для промислового виготовлення. Тому виробники були змушені створювати свої наукові підрозділи, спеціальні конструкторські лабораторії, розробляючи ефективні препарати самі або запозичувати імпортні технології. А це, в свою чергу, потребувало затрат часу і капіталовкладень.
- Застаріла і недосконала нормативно-правова база, яка не передбачає активного розвитку даного напрямку господарювання.
Наприклад, в Україні передбачено здійснювати перереєстрацію ветеринарного препарату кожні 5 років до кінця його існування. А в Європейському Союзі вважають достатнім терміном перевірки якості і безпечності препарату 5 років, після чого препарат проходить перереєстрацію з необмеженою дією реєстраційного посвідчення.
На ринку ветеринарних препаратів України знаходяться переважно генеричні препарати (генерик, взаємозамінний), але у законодавстві немає навіть їх визначення. А тому реєструють їх як оригінальні препарати, що потребує надання контролюючій організації значно більшої кількості інформації, коштів і витрат часу для реєстрації.
- Використання субстанцій у якості лікарських засобів.
У світі немає аналогу українському «ноу-хау» – застосуванню для лікування тварин активно діючої речовини (субстанція, АФІ) без використання лікарської форми. У нас досить часто 100% чистий антибіотик використовують для лікування і профілактики хвороб тварин і птиці у промислових масштабах. Тобто, якщо для досягнення терапевтичного ефекту необхідно 5 – 20% діючої речовини, то використання чистої діючої речовини – у 10-20 разів діє сильніше, ніж це необхідно для досягання терапевтичного ефекту. Це негативно впливає на якість тваринницької продукції, а найголовніше – на навколишнє середовище і екологічну безпеку країни. Застосування таких методів лікування тварин призводить до селекції надзвичайно стійких до лікарських засобів штамів мікроорганізмів. Це несе в собі велику загрозу здоров’ю людей. Бо викликавши захворювання у людини такий мікроорганізм не знешкоджується препаратами вибору, хвороба не лікується, а за час, що потрібен для встановлення діагнозу, виділення мікроорганізму та визначення його чутливості до антибактеріальних препаратів можливі тяжкі ускладнення перебігу та летальні наслідки.
- Широке розповсюдження фальсифікованої та контрабандної продукції. В окремих випадках обсяги фальсифікованої продукції сягають до 70% переліку продукції компаній. Такі препарати завдають шкоди здоров’ю тварин, економічних і іміджевих збитків держави в цілому. Чого вартий лише один випадок бракування українського меду в Чехії, коли були знайдені залишки антибіотиків. Розслідування показало, що бджолярі застосовували контрабандні препарати, на маркуванні яких не було вказано про наявність антибіотиків у складі препарату. Навіть поодинокі дослідження ринку ветеринарних препаратів, проведені Державним науково-контрольним інститутом ветеринарних препаратів і кормових добавок, вказують на широку географію контрабандних та фальсифікованих препаратів. Враховуючи обмеженість проведеної роботи можна спрогнозувати, що ця незаконна діяльність перевершує за обсягами діяльність легальну. Тіньовий обіг фальсифікованих і контрабандних ветеринарних препаратів і кормів для тварин сягає сотень мільйонів гривень. Детальніше інформацію можна подивитися на сайті інституту за посиланням www.scivp.lviv.ua.
Виробники фальсифікату та реалізатори контрабанди почуваються вільно, вправно маніпулюють попитом на ринку завдяки низькій ціні (низькопробна продукція дає таку змогу), спокійно живуть через мораторій на перевірки та послаблення ліцензійного законодавства, крадуть інтелектуальну власність, обдурюючи споживачів. Серед тих, що фальсифікують і реалізовують фальсифіковану продукцію компаніїї: ТОВ «Коллен», ТОВ ВФ “Базальт”, ПП “O.L.KAR– АгроЗооВетСервіс, ТОВ “Дослідно-експериментальне виробництво інституту епізоотології”, ТОВ «Укрветбіофарм», ДВП «Скіф», ПП “Зооветпром”, ВК “КРУГ”, ТОВ «Біофарм» м. Літин.
Серед контрабандних товарів переважають препарати виробництва Російської Федерації, доля яких на ринку України серед усіх контрабандних препаратів сягає 50%. Виявлено близько 100 найменувань контрабандних ветеринарних препаратів (або підроблених під відомі фірми) виробництва Німеччини, Чехії, Словакії, Іспанії, Бельгії, США та виробників інших країн. Навіть обмежений аналіз виявив контрабандні товари в таких дистриб’юторських мережах: Ветеринарний Маркет (м. Львів), Зооаптека Рижий Кіт (м. Київ), ZOOPARADISE (м. Харків), Ветаптека www.vetapteka.kiev.ua (м. Київ), MIKA–VET (м. Київ), Харківська ветклініка (м. Харків), ВетАптека (м. Львів), Доктор Зоо (м. Київ), ЮснаСуперБіо (м. Київ), УКРВЕТКОМ (м. Дніпропетровськ).
Вітчизняна законодавчо-нормативна база не має ефективних важелів боротьби з контрабандною і фальсифікованою продукцією ветеринарного призначення. Навіть визначення «фальсифікований ветеринарний препарат» відсутнє. Тому удосконалення ветеринарної законодавчо-нормативної бази зі змінами у адміністративний та кримінальний кодекси могло б принести значний ефект і для здоров’я тварин, і для здоров’я людей, зберегти навколишнє середовище, і в кінці кінців поповнити бюджет країни за рахунок легальних податків.
Отже, проблеми розвитку вітчизняної індустрії ветеринарних препаратів і пов’язаної з ним проблеми забезпечення людей якісними продуктами тваринництва, мають комплексний характер. І для їх вирішення необхідний комплексний підхід і увага як держави так і суспільства в цілому. Бо від їх невирішеності потерпають, перш за все, громадяни України.
ПРОБЛЕМИ ВИРОБНИЦТВА ВЕТЕРИНАРНИХ ПРЕПАРАТІВ
В.Г. Скрипник, доктор ветеринарних наук, старший науковий співробітник,
генеральний директор Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок.
І.А. Березовська, кандидат юридичних наук, старший науковий співробітник,
начальник юридичної служби ТОВ «Бровафарма».
В статті обгрунтовується необхідність гармонізації української нормативно-правової бази, що регулює виробництво та обіг ветеринарних препаратів, до нормативних документів ЄС. Наводиться конкретний перелік нормативних документів, які необхідно гармонізувати або анулювати, аналізуються переваги та ризики переходу використання нормативної бази ЄС. Надається висновок щодо необхідності впровадження в Україні норм GMP і GDP як основних гарантів безпечності та якості виготовленої продукції.
Ключові слова: нормативно правова база, ветеринарні препарати, виробництво, дистриб’юція, Європейське Співтовариство
Утворення Державної служби з питань безпечності харчових продуктів та захисту споживачів передбачає значний поворот у світогляді діяльності ветеринарної служби, її наближення до потреб суспільства через збільшення сервісних функцій з одного боку та переосмислення і впорядкування інспекторських функцій з другого боку. Через призму такої зміни світогляду повинні розглядатися і взаємини нової Державної служби та вітчизняної індустрії виробництва ветеринарних препаратів.
Для розуміння подальших напрямків та конкретних кроків співпраці державної служби з виробниками ветеринарних препаратів спробуємо з’ясувати нормативно-правову базу, яка є фундаментом цих стосунків.
Таблиця 1.
Нормативно-правові документи, які регулюють виробництво та дистрибуцію ветеринарних препаратів в Україні та ЄС.
| Європейське співтовариство | Україна |
| Директива Європейського Парламенту та Ради про Кодекс Співтовариства щодо лікарських засобів для ветеринарного застосування № 2001/82/ЄС від 6 листопада 2001 року (в консолідованій редакції з урахуванням всіх подальших змін до неї; останні зміни наразі внесені Директивою № 2009/53 від 18.06.2009 року);
Директива Комісії, що визначає принципи і напрямки належної практики виробництва лікарських препаратів ветеринарного призначення №91/412 від 23 липня 1991 року (Директива про GMP); Регламент Ради, що запроваджує процедури Співтовариства щодо надання дозволів та нагляду за лікарськими засобами для використання людьми та для ветеринарних цілей та яким засновується Європейське агентство оцінки лікарських засобів N 2309/93 від 22.06.93 року;
|
Закон України «Про ветеринарну медицину» (Розділ 10, 11, ст.63-78).
Постанова Кабінету Міністрів України від 07.05.1998 за № 637 «Положення про Національний центр штамів мікроорганізмів і порядок депонування штамів мікроорганізмів» Наказ Держдепартаменту ветмедицини від 04.12.2002 за № 70 «Про затвердження інструкції про порядок зберігання, підтримання. Відпуску, завезення в Україну і вивезення штамів мікроорганізмів…………..» Наказ Держкомпідприємництва та МінАПУ від 14.10.2002 за №108/329 «Про затвердження Ліцензійних умов провадження господарської діяльності з виробництва ветеринарних медикаментів і препаратів, оптової, роздрібної торгівлі ветеринарними медикаментами і препаратами. Наказ Держдепартаменту ветмедицини від 13.08.2002 за № 44 «Про затвердження Правил транспортування та зберігання ветпрепаратів, субстанцій, готових кормів, кормових добавок та засобів ветеринарної медицини у ветаптеках, їх структурних підрозділах, на базах, складах тощо» Наказ Держдепартаменту ветмедицини № 39 від 28.05.2003, про Про затвердження Положення про проведення державного контролю та нагляду за якістю ветеринарних препаратів, субстанцій, готових кормів, кормових добавок та засобів ветеринарної медицини, які застосовуються в Україні”* Наказ Держкомпідприємництва та МінАПУ від 15.12.2003 за №132/444 «Про затвердження Порядку контролю за додержанням Ліцензійних умов провадження господарської діяльності з виробництва ветеринарних медикаментів і препаратів, оптової, роздрібної торгівлі ветеринарними медикаментами і препаратами» Наказ Держдепартаменту ветмедицини від 10.03.2005 за №21 «Про затвердження Порядку проведення атестації ВБК підприємств-виробників ветеринарних імунобіологічних препаратів та Порядку проведення атестації виробництв ветеринарних імунобіологічних препаратів» Наказ Держдепартаменту ветмедицини від 08.08.2005 за № 68 «Керівництво з проведення атестації виробництв ветеринарних імунобіологічних препаратів» Постанова Кабінету Міністрів України N 1349 від 21.11. 2007 “Про затвердження Положення про державну реєстрацію ветеринарних препаратів» Наказ Державного комітету ветеринарної медицини України 14.07.2008 N 133 «Про затвердження форм заяв, переліку матеріалів реєстраційного досьє та порядку його формування». Постанова Кабінету Міністрів України від 01.07.2009 за № 652 «Про затвердження Порядку видачі дозволу на ввезення на територію України тварин, продуктів тваринного походження, репродуктивного матеріалу, біологічних продуктів, патологічного матеріалу, ветеринарних препаратів, субстанцій, кормових добавок, преміксів та кормів» Наказ Держдепартаменту ветмедицини від 10.08.2010 за № 324 «Про затвердження Змін до Правил транспортування та зберігання ветпрепаратів, субстанцій, готових кормів, кормових добавок та засобів ветеринарної медицини у ветаптеках, їх структурних підрозділах, на базах, складах тощо» МЕТОДИЧНІ РЕКОМЕНДАЦІЇ щодо основних правил належної практики виробництва та контролю якості ветеринарних препаратів, 2014 |
- – наказ скасовано
Зрозуміло, що це не всі документи, а лише основні. І навіть із попереднього розгляду даної таблиці стає наглядною необхідність упорядкування та дерегуляції процесів реєстрації, виробництва та дистрибуції ветеринарних препаратів. З іншого боку складається уява про непохитність дій усіх контролюючих органів у плані забезпечення якості та безпечності ветеринарних препаратів. На практиці ж все відбувається не зовсім так. І, як досить часто у нашій державі, кількість регулятивних документів і їх жорсткість компенсуються «необов’язковістю» та відсутністю контролю за їх виконанням. А тому ринок ветеринарних препаратів насичений фальсифікованими, контрабандними та й просто невідомими продуктами. Який же вихід із даної ситуації? Нам здається, що найкращим виходом є шлях до євроінтеграції яким намагається рухатися Україна.
Чи можливий сьогодні вихід вітчизняних виробників ветеринарних препаратів на європейський ринок? Певно, що ні. Але крім європейського ринку є ще ненасичені ринки інших континентів, де необхідно займати існуючі ніші. То до чого тут європейська нормативна база? Все досить просто. Світова спільнота вже давно погодилася з тим, що в ЄС найбільш прогресивна та потужна нормативна база. А дотримання вимог ЄС свідчить про безпечність і якість продукції, робить її конкурентоздатною. Тому продукція, виготовлена за європейськими стандартами, користується попитом і в Азії, і в Африці, знаходить свого споживача в країнах СНД.
Але необхідно розуміти, що реформи у ветеринарній медицині в цілому та у сегменті виробництва ветеринарних препаратів зокрема, несуть у собі крім очевидних переваг ще й низку викликів, які треба враховувати та нівелювати.
Таблиця 2
Переваги та виклики при реформуванні ветеринарної медицини
| Перспективи | Виклики |
| Зменшення адміністративного навантаження (спрощення дозвільних процедур, зменшення відповідальності держави) та витрат на контроль | Збільшення відповідальності виробників |
| Зникає захист дозвільного документу («паперовий щит») | |
| Неможливість оперативного реагування на кризові ситуації
|
|
| Адаптація норм законодавства ЄС та відсутність необхідності витрат на розробку власних нормативних документів і витрат на їх впровадження | Гармонізація вимог ЄС без наукового обгрунтування |
| Невдала адаптація вимог і норм ЄС | |
| Подвійне трактування вимог і норм ЄС | |
| Неготовність виконувати вимоги і норми ЄС | |
| Неготовність проконтролювати відповідність вимог (відсутність компетентності у інспекторів та необхідність навчання) | |
| Відсутність оцінки їх відповідності вітчизняним умовам |
Зважаючи на викладене вище та враховуючи європейський вектор розвитку України члени Української асоціації виробників і дистриб’юторів ветеринарних препаратів та кормових добавок вважають гармонізацію ветеринарного законодавства України з правом ЄС єдино правильною дією, яка відповідає вимогам часу. Саме це має забезпечити правову основу для контролю за якісним і безпечним виробництвом ветпрепаратів та дозволити вітчизняній продукції вийти на ринок Європейського Союзу та інших країн світу, що визнають стандарти ЄС, а також забезпечити правову основу для контролю за обігом ветпрепаратів на ринку України.
Власне правове регулювання обігу ветпрепаратів в ЄС базується на таких принципах:
– ветеринарні препарати, дозволені для продажу на європейському ринку, виготовляються лише виробниками, що мають відповідну ліцензію на виробництво (manufacturing authorization), діяльність яких регулярно інспектується компетентними уповноваженими органами;
– кожен ветеринарний препарат, що виробляється, має бути зареєстрованим, тобто мати реєстраційне посвідчення (marketing authorization), що засвідчує проведення його експертизи у компетентному уповноваженому органі;
– якість лікарських засобів для ветеринарії забезпечується дотриманням виробником вимог належної виробничої практики (Good Manufacturing Practice – GMP);
– високий рівень якості вироблених ветеринарних препаратів підтримується в мережі дистрибуції, завдяки дотриманню постачальниками вимог належної дистрибуційної практики (Good Distribution Practice – GDP).
Тому для української ветеринарної фармпромисловості гармонізація ветеринарного законодавства є нагальною необхідністю, що обумовлена вимогами ринкової економіки: ЄС допускає на власний внутрішній ринок лише ветеринарні препарати, вироблені відповідно до стандартів якості, адекватних його стандартам, зокрема GMP.
Економічні реалії та необхідність зміцнення експортного потенціалу вітчизняної ветеринарної фарміндустрії зумовлює нагальну потребу у визначенні державної політики щодо реформування української ветеринарної фармацевтичної промисловості та прийнятті плану заходів з розробки нормативно-правових актів в сфері обігу ветеринарних препаратів, гармонізованих з законодавством ЄС. Але при цьому необхідно враховувати, що комплексна гармонізація ветеринарного законодавства України з правом ЄС потребує зваженої політики компетентних органів державної влади й обов’якового урахування інтересів українських виробників. Метою такої гармонізації має бути створення належних правових умов для забезпечення якості і безпечності ветеринарних препаратів, що знаходяться на українському ринку. Це забезпечить:
– високу якість ветеринарних препаратів вітчизняного виробництва та їх конкурентоздатність;
– обмежений доступ на ринок України імпортних препаратів низької якості;
– високий захист споживачів від фальсифікованої продукції;
– неможливість використання контрабандної продукції.
Усвідомлюючи всі вищеперераховані аспекти, Українська асоціація виробників і дистриб’юторів ветеринарних препаратів та кормових добавок ініціювала проведення гармонізації вітчизняної нормативної бази з законодавством ЄС. Результатом такої роботи є напрацьовані зміни до Закону України «Про ветеринарну медицину», деяких наказів ДВФСУ які стосуються реєстрації ветпрепаратів, анулювання декількох антиринкових наказів. Спільно з депутатським корпусом ВР України та ДВФСУ робота по гармонізації вітчизняної нормативної бази з законодавством ЄС і дерегуляції виробництва, реєстрації та обігу ветпрепаратів продовжується.
Висновки.
- Перехід вітчизняного виробництва та дистрибуції ветеринарних препаратів на норми Європейського Союзу (GMP і GDP) – вимога часу до розвитку індустрії виробництва та гарантованої якості ветеринарних препаратів.
- Розбудова взаємовідносин між державними органами влади та виробниками і дистрибуторами ветеринарних препаратів у нинішніх умовах – це кропітка праця по підготовці сучасної вітчизняної нормативної бази та її гармонізації з законодавством ЄС. Ця робота уже неможлива без активної участі громадських організацій і суспільства в цілому.